16 Giu Management per la prevenzione del rischio trombotico correlato a PICC
Management for the prevention of the thrombotic risk related to PICC
INTRODUZIONE
I PICC (Peripherally Inserted Central Catheters, cateteri venosi centrali a inserzione periferica) sono un dispositivo per accesso venoso costituito da un catetere in materiale biocompatibile che, inserito in una vena periferica (nella maggior parte dei casi, dell’arto superiore), raggiunge una posizione “centrale”, ovvero la zona di transizione tra la vena cava superiore e l’atrio destro (Pittiruti e Scoppettuolo, 2016).
Questi cateteri venosi presentano indubbi vantaggi:
- non necessitano di ricovero ospedaliero per essere impiantati;
- maggiore comfort per il paziente e minore impatto sull’immagine corporea;
- possono essere posizionati da personale infermieristico opportunamente formato, in taluni casi anche a domicilio;
- brevissimi tempi d’attesa per il posizionamento;
- precoce inizio delle terapie farmacologiche (ad esempio una chemioterapia);
- preservazione del patrimonio venoso del paziente e riduzione delle complicanze;
- presidio ponte in attesa dell’impianto di uno di lunga durata (ad esempio i port a cath);
- bassi indici di CRBSI rispetto ai tradizionali CVC.
Le potenziali complicanze di tali dispositivi sono rare ma non del tutto trascurabili. Le complicanze possono essere precoci o tardive. Tra le prime, direttamente correlate alla procedura di impianto, ricordiamo: il fallimento della incannulazione venosa o il suo successo soltanto dopo molti tentativi di venipuntura, la puntura accidentale di arterie o strutture nervose, ematomi locali, ed aritmie. Tra le complicanze tardive le più importanti annoveriamo le infezioni sistemiche o locali, i malfunzionamenti del sistema, le dislocazioni secondarie e le trombosi venose periferiche e/o centrali. Nella prevenzione delle infezioni batteriche da catetere venoso si è diffuso il concetto targeting zero, ossia la possibilità/necessità di tendere ad azzerare le complicanze prevenibili. È però possibile tentare di minimizzare o azzerare ogni tipo di complicanza prevenibile, non soltanto quelle infettive, ma anche quelle meccaniche e trombotiche. Oggi si possono adottare strumenti e tecnologie a basso costo in grado di ridurre significativamente i rischi connessi all’impianto degli accessi venosi e sono disponibili metodologie e strategie di comportamento, basate sulle evidenze, efficaci nel ridurre l’incidenza di complicanze senza aumentare i costi o i tempi della manovra di impianto. Benché nessuna strategia o tecnologia sia da sola sufficiente a minimizzare le complicanze dell’impianto, è possibile individuare un insieme di raccomandazioni di particolare rilevanza ed efficacia clinica, in grado di agire sinergicamente in senso positivo sull’esito clinico della manovra. Pertanto, l’obiettivo di questo contributo è di sintetizzare le migliori evidenze disponibili riguardanti la gestione degli accessi venosi ad inserzione periferica, nell’ottica di prevenzione della complicanza trombotica PICC correlata.
EVIDENZE
Riteniamo che, sulla base della letteratura presente sul tema e alla nostra consolidata esperienza, per azzerare o minimizzare l’incidenza di complicanze PICC-correlate, sia indispensabile un programma aziendale che preveda i seguenti punti:
- Sorveglianza. Per poter definire la necessità e valutare l’effetto delle strategie di prevenzione della complicanza trombotica è essenziale che ogni unità operativa registri l’incidenza dell’evento, possibilmente espressa in unità di misura che faciliti il confronto tra unità operative con diverse policies e con la letteratura di riferimento (ad esempio, numero di complicanze per ogni 1000 giorni di vita catetere).
- Audit clinici. Ogni unità operativa dovrebbe prendere in considerazione la possibilità di identificare un referente medico e uno infermieristico per effettuare una registrazione della complicanza, secondo definizioni prestabilite, in modo da poterle valutare all’interno dell’unità operativa e anche a livello aziendale, coinvolgendo gli organismi deputati al risk management; periodicamente, dovrebbero essere organizzati degli audit con i responsabili medici e infermieristici dei singoli reparti, per discutere i resoconti del periodo e affrontare eventuali criticità segnalate.
- Utilizzo di bundle e checklist. In accordo con quanto suggerito dalle linee guida internazionali, i principali strumenti forniti agli operatori sanitari da applicare nella pratica clinica quotidiana per la prevenzione delle complicanze catetere correlate è rappresentato dai bundle, ovvero un insieme di poche raccomandazioni provatamente efficaci nella prevenzione della complicanza trombotica correlata al PICC, e checklist, ovvero di elenchi dettagliati dei punti salienti di ogni singola manovra, allo scopo di verificare in tempo reale la correttezza dell’esecuzione di ciascuna procedura.
- Formazione degli operatori. Un’adeguata formazione (e addestramento) degli impiantatori riduce drasticamente l’incidenza del rischio legato sia alle complicanze immediate al posizionamento, sia alle complicanze che compaiono tardivamente ma che sono comunque legate ad una tecnica di inserzione o di gestione errata della manovra d’impianto.
Per realizzare un programma aziendale di questa portata risulta dunque fondamentale la presenza di un Team specificamente dedicato agli Accessi Vascolari (Pittiruti e Scoppettuolo, 2016).
Team degli accessi vascolari (TAV)
La creazione di un team multiprofessionale e multidisciplinare, che veda coinvolti in sinergia medici e infermieri specialisti nell’impianto e nella gestione degli accessi venosi, rappresenta un valore aggiunto per l’appropriatezza delle cure (INS, 2016): essa facilita l’integrazione professionale, la standardizzazione delle procedure, il monitoraggio dell’attività tramite indicatori definiti, al fine di garantire la qualità e sicurezza delle prestazioni. Un team specializzato in accessi vascolari è, come già sottolineato, un team multi-professionale: al suo interno sono presenti figure mediche e infermieristiche. Il TAV si avvale anche della consulenza dei farmacisti per quanto riguarda l’aspetto di scelta e approvvigionamento dei dispositivi. I professionisti infermieri dovrebbero possedere competenze avanzate sugli accessi vascolari (Master universitari, formazione ad hoc per gli impianti e la gestione).
I vantaggi di un Team multi-professionale e multi-disciplinare sono numerosi:
- Copertura di uno spettro più completo di competenze;
- Possibilità di rapido ‘shift’ ad accesso centrale diretto (competenza non infermieristica), qualora richiesto dalle condizioni cliniche;
- Presenza all’interno del Team di ‘know-how’ per la prevenzione e gestione di qualunque complicanza infettiva, meccanica o trombotica (multiprofessionalità ma anche multidisciplinarietà: collaborazione con ematologo, infettivologo, chirurgo, radiologo).
Il TAV permette un’esperienza clinica unica per la quantità di casi, per la varietà di pazienti, per la varietà di presidi utilizzati, per la tipologia di attività, per l’interconnessione tra attività clinica e attività formativa e, infine, per l’interconnessione tra attività clinica e attività scientifica. L’attività del TAV, infatti, si esplica, non solo nel posizionamento del device, ma anche nella consulenza, nella formazione continua degli operatori sanitari delle unità operative sull’appropriatezza di richiesta e successiva corretta gestione di un accesso vascolare e sulla costruzione di database contenenti informazioni di processo ed esito correlate alle attività di impianto e gestione; in generale, contribuisce alla diffusione della cultura delle good clinical practices. Il TAV può costituire per l’Azienda un punto di riferimento per la valutazione, le conoscenze ed i comportamenti da tenere nella gestione degli accessi vascolari. Altro fondamentale ruolo del TAV, è quello di prevenzione, gestione e sorveglianza delle complicanze, compresa quella trombotica, quindi la creazione e la standardizzazione di strategie di prevenzione e trattamento e la verifica del loro effetto.
La presenza di un Team degli Accessi Vascolari comporta significativi vantaggi in termini di sicurezza, di costo-efficacia e di efficienza:
- l’attuazione completa e sistematica, a livello di tutta l’azienda, di un programma di scelta ragionata del presidio (proactive vascular planning);
- la riduzione delle complicanze e dei costi legati all’impianto, grazie all’adozione di una tecnica standardizzata e condivisa, eseguita da personale con esperienza e training specifici;
- l’attuazione di un servizio continuativo di consulenza per la gestione routinaria degli accessi venosi (tramite la formulazione e attuazione di bundles o di protocolli operativi adeguati) e per la gestione di eventuali complicanze infettive o trombotiche o meccaniche;
- il mantenimento di un’attività culturale e formativa continua a livello aziendale, finalizzata all’aggiornamento delle procedure e dei protocolli inerenti
- l’impianto e la gestione degli accessi venosi.
La modalità organizzativa indicata favorisce l’inserimento del paziente che necessita di un accesso vascolare in un percorso clinico assistenziale che lo accompagna dalla richiesta alla rimozione dello stesso.
Formazione per tutti gli operatori sanitari
Come già accennato in precedenza, ruolo del TAV è anche quello legato alla formazione di tutti gli operatori sanitari. Il Team degli Accessi Vascolari prevede corsi di formazione e aggiornamento per tutti i professionisti sanitari che si trovano a gestire i device vascolari. Sono previsti due tipi di corsi di formazione: il corso base e quello avanzato. Il corso base: l’attività formativa ha come scopo quello di promuovere l’appropriatezza della scelta dell’accesso vascolare e la successiva gestione del device. Il corso avanzato: ha come scopo quello di fornire competenze più avanzate, come per esempio l’utilizzo dell’ausilio ecografico per l’impianto delle cannule periferiche lunghe (minimidline) e dei cateteri midline.
I bundle
Il bundle è un insieme di pratiche evidence-based che, applicate congiuntamente e in modo adeguato, migliorano la qualità e l’esito dei processi con un effetto maggiore di quello che le stesse determinerebbero se fossero attuate separatamente.
Le principali caratteristiche che identificano un bundle sono:
- la legge del “tutto o nulla”, cioè un bundle ha successo solo se tutte le sue componenti vengono applicate;
- deve essere facilmente gestibile e, quindi, composto da un numero limitato di azioni attuabili in maniera sostenibile, facili da memorizzare e semplici da monitorare;
- include solo alcune tra tutte le possibili strategie applicabili, quelle più solide in termini di evidenze scientifiche, da cui derivano sicuri vantaggi in termini di esito delle cure;
- gli elementi del bundle sono tra loro relativamente indipendenti, per cui se una delle pratiche non è applicabile a un determinato paziente, l’applicazione delle altre azioni previste dal bundle non ne viene inficiata;
- la sua compliance, definita come la percentuale di pazienti ai quali vengono applicate tutte le strategie del bundle, deve essere perfettamente misurabile (Resar, 2012).
L’applicazione del bundle, però, non comporta l’esclusione di altre pratiche evidence-based, che non sono state incluse.
Il bundle è personalizzabile a un determinato contesto di cura, lo staffing può definire le raccomandazioni del bundle sulla base delle priorità di intervento di buona pratica. I bundle sono descrittivi e non prescrittivi, in modo da consentirne la contestualizzazione a livello locale da parte dei professionisti clinici: questo determina il coinvolgimento consapevole, il confronto costruttivo e la partecipazione attiva dei professionisti al progetto di miglioramento.
La costruzione di un bundle parte da prove supportate da almeno una review sistematica di studi clinici ben progettati, randomizzati, controllati (RCT), oppure su dati di almeno un RCT ben progettato (Aboelela, 2007). Di seguito due esempi di bundle progettati dagli autori.

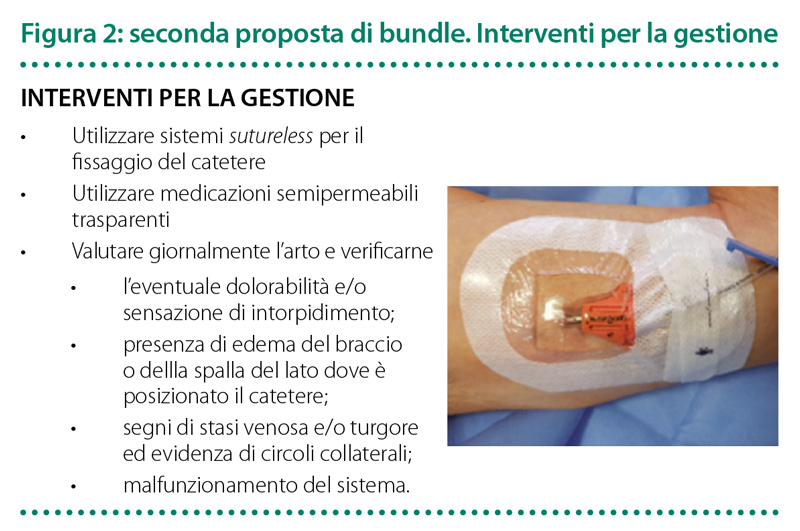
Gli audit clinici
L’audit clinico è un processo con cui medici, infermieri e altri professionisti sanitari, effettuano una revisione regolare e sistematica della propria pratica clinica e, dove necessario, la modificano (Primary Health Care Clinical Audit Working Group, 1995).
L’audit è lo strumento che permette di verificare le capacità di fornire e mantenere livelli assistenziali di qualità elevata, valutando e misurando le differenze riscontrate nella pratica assistenziale rispetto a standard esplicitamente definiti.
Le caratteristiche fondamentali dell’audit clinico sono:
- coinvolge tutti i professionisti sanitari;
- è un’attività continua e sistematica che non può essere limitata a singoli casi;
- ha come oggetto principale l’appropriatezza dei processi (anche se può essere utilizzato per misurare gli esiti assistenziali);
- permette di misurare il grado di inappropriatezza (in eccesso e/o in difetto) e identificare quali aree della pratica professionale devono essere oggetto di miglioramento.
I sistemi di auditing possono verificare:
- l’appropriatezza e la tracciabilità delle pratiche assistenziali tramite audit retrospettivi realizzati dai clinici (medici e infermieri);
- la compliance dei comportamenti tramite audit osservativi.
Il clinical audit si articola in sei fasi, attraverso una struttura circolare che a ogni ciclo successivo mira a raggiungere target di qualità sempre più elevati.
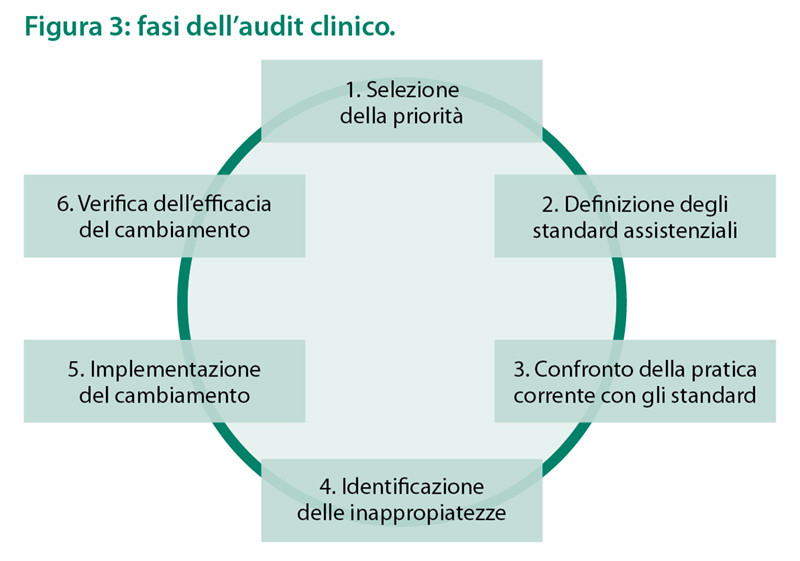
- Selezione delle priorità. Rappresenta la fase cruciale, in grado di condizionare il successo dell’audit clinico: in particolare, è fondamentale che la priorità definita, oltre a richiamare l’interesse dei professionisti, sia rilevante per l’organizzazione sanitaria. Esistono alcuni criteri generali per definire le priorità: consistente impatto sulla salute (in termini di frequenza, gravità, qualità della vita), consumo di risorse, ampia variabilità della pratica clinica, disponibilità di evidenze di grado elevato.
- Definizione degli standard assistenziali. Idealmente, uno standard assistenziale dovrebbe essere: evidence-based, condiviso tra i professionisti e adattato al contesto locale. Questi “fattori prognostici favorevoli”, che massimizzano la probabilità dell’implementazione, generalmente si ottengono tramite l’adattamento locale di linee guida (LG) – previa validazione della loro qualità – in percorsi assistenziali (PA) condivisi tra tutti i professionisti che devono utilizzarli.
- Confronto della pratica corrente con gli standard. Attraverso la revisione, idealmente retrospettiva, della documentazione clinica, viene esaminato il grado di aderenza della pratica corrente con gli standard definiti.
- Identificazione delle inappropriatezze. L’analisi dei dati raccolti fornisce una stima delle inappropriatezze, sia in eccesso, sia in difetto: in particolare, accanto al mancato impiego di interventi sanitari efficaci, vengono spesso prescritti interventi inappropriati.
- Implementazione del cambiamento. In relazione alle inappropriatezze rilevate, viene attuato il piano di cambiamento, utilizzando efficaci strategie d’implementazione multifattoriali.
- Verifica dell’efficacia del cambiamento. Dopo un periodo variabile, si verifica l’impatto dell’audit clinico sulla pratica professionale: in particolare, è atteso un aumento dell’appropriatezza degli interventi sanitari oggetto dell’audit. In relazione ai risultati rilevati, cicli successivi di audit possono richiedere strategie di implementazione integrative, al fine di raggiungere i target desiderati (Cartabellotta, 2009).
IMPLICAZIONI
La corretta gestione dei PICC non può essere semplicemente il frutto di un’iniziativa di singoli operatori sanitari, ma deve essere inquadrata nell’ambito di un progetto specifico per l’ottimizzazione dell’accesso venoso. Ciò implica la definizione di una serie di condizioni di appropriatezza in termini di indicazione, modalità di impianto e di gestione, senza le quali si rischia un cattivo utilizzo dei PICC e un aumento delle complicanze ad essi potenzialmente associate (in primis la trombosi). Ciò implica, innanzitutto, in ambito aziendale, la definizione di un TAV composto da operatori sanitari esperti nel posizionamento degli accessi venosi per via periferica, specificamente formati e addestrati. Ruolo del TAV non è soltanto quello legato all’impianto del dispositivo, ma anche quello legato alla consulenza, sia sulla scelta dell’accesso venoso sia sulle strategie diagnostico-terapeutico-assistenziali in caso di complicanze, e quello legato alla formazione. Innanzitutto, è necessario ottimizzare la qualità dell’impianto di PICC, il che prevede la definizione di specifiche procedure aziendali, che descrivano in dettaglio (con annessa checklist operativa) la tecnica d’impianto di questi dispositivi. Le basi su cui deve fondarsi tale protocollo sono: corretta tecnica di asepsi e antisepsi, l’uso dell’ecoguida, il rapporto calibro – vena, l’uso della tecnica di Seldinger, la verifica del posizionamento della punta con metodo dell’ECG intracavitario, l’uso di suturless device.
Per quanto riguarda invece i fattori di rischio correlati al paziente sarebbe opportuno, inoltre, introdurre una scala di valutazione legata al rischio trombotico del paziente. In base allo score risultante, si potrebbero escludere alcuni pazienti dal posizionamento di un PICC, optando piuttosto per un altro device, oppure si potrebbe iniziare precocemente una terapia profilattica. Il punto più arduo è l’ottimizzazione della gestione. Addestrare a un’adeguata gestione tutti gli operatori sanitari di un’unità operativa o, peggio ancora, dell’azienda, è un compito assai complesso che richiede diversi interventi strategici:
- La definizione di procedure aziendali, che stabiliscano in modo preciso i principi fondamentali per la corretta medicazione dei PICC.
- Un programma adeguato di formazione continua del personale, in grado di diffondere in modo efficace le nozioni, progettato in modo da prevedere un audit finale e dei refresh a distanza programmata.
- La diffusione nelle singole unità operative di bundle, che riassuma in modo efficace e sintetico le procedure di gestione, atte a prevenire il rischio trombotico.
- Un’implementazione a livello aziendale dei programmi di sorveglianza e monitoraggio della complicanza trombotica correlata al PICC.
In conclusione, la definizione appropriata di procedure aziendali, bundle per la prevenzione di tale complicanza, l’istituzione di un team di operatori sanitari dedicati, nonché una percezione dell’importanza della qualità dell’addestramento e della formazione, sono i capisaldi per ottenere che la sicurezza e la gestione cost-effective dei PICC possano essere valorizzati al massimo, per il bene dei pazienti e per l’efficienza delle aziende ospedaliere.
BIBLIOGRAFIA
- Aboelela SW et al., (2007), Effectiveness of bundled behavioural interventions to control healtcare-associated infections: a systematic review of the literature, Journal of Hospital Infect
- Cartabellotta A., (2009), Audit clinico: questo sconosciuto (I). Saga in tre episodi su uno strumento chiave della Clinical Governance, GIMBEnews.
- Cerotto V. et al., (2018), Le buone pratiche per gli accessi vascolari, Buone pratiche cliniche SIAARTI.
- Dawson RB., (2011), PICC zone insertion method (ZIM): a systematic approach to determinate the site for PICCs in the upper arm, JAVA.
- Emoli A. et al., (2014), Il protocollo ‘ISP’ (Inserzione Sicura dei PICC): un “bundle” di otto raccomandazioni per minimizzare le complicanze legate all’impianto dei cateteri centrali ad inserimento periferico (PICC), Assistenza infermieristica e ricerca.
- Grove J. R., et al., (2000), Venous thrombosis related to peripherally inserted central catheters, Journal of Vascular and Interventional Radiology.
- Hinchliff S. M., Montague S. E., Watson R., (2004), Fisiologia per la pratica infermieristica, Milano: Casa Editrice Ambrosiana.
- O’Grady NP, Alexander M, Burns LA, Dellinger EP, Garlandd J, Heard SO, et al., (2011), Healthcare Infection Control Practices Advisory Committee:
- Guidelines for the prevention of intravascular catheter- related infections, American Journal of Infection Control.
- Ong B, Gibbs H, Catchpole I, Hetherington R, Harper J., (2006), Peripherally inserted central catheters and upper extremity deep vein thrombosis, Australasian Radiology.
- Institute for Healthcare Improvement, (2008), Five million lives campaign.
- Pittiruti M., Capozzoli G., (2016), Manuale pratica dell’accesso venoso – Indicazione, Impianto, gestione, Roma: Antonio Delfino Editore.
- Resar R et al., (2012), Using Care Bundles to Improve Health Care Quality. IHI Innovation. Series white paper. Cambridge, Massachusetts: Institute for Healthcare Improvement.
- Walshe LJ., (2001), Complication rates among cancer patients with peripherally inserted central catheters, Journal of Clinical Oncology.

Eleonora Fernandi
Infermiera, Dipartimento di Oncoematologia, Ospedale Guglielmo da Saliceto (Piacenza)
RN, Oncohematology Dept., Ospedale Guglielmo da Saliceto (Piacenza, Italy)
eleonora.fernandi@libero.it

Gabriele Cremona
Coordinatore Infermieristico, Dipartimento di Oncoematologia, Ospedale Guglielmo da Saliceto (Piacenza)
Chief Nurse, Oncohematology Dept., Ospedale Guglielmo da Saliceto (Piacenza, Italy)

Luigi Cavanna

