01 Feb Le buone pratiche assistenziali per l’esecuzione dell’emocoltura: una revisione della letteratura
Good nursing practices for performing blood culture: a review of the literature
ABSTRACT
Introduzione. L’emocoltura rappresenta il gold standard nella diagnosi microbiologica di sepsi e/o febbre di origine sconosciuta. Se fatto correttamente, è lo strumento migliore per gestire il “fenomeno della sepsi” in tutte le possibili manifestazioni. Lo scopo del lavoro è condurre una revisione della letteratura per evidenziare le buone pratiche delle emocolture nei pazienti ospedalizzati per prevenire le non conformità. Materiali e metodi. Viene condotta una revisione della letteratura con la definizione della domanda di ricerca attraverso la formulazione del PICO. La ricerca è stata condotta su tre importanti database, Pubmed, Scopus e Cochrane Library. Risultati. Dall’analisi dei dati è emerso che sono molteplici i fattori che possono influenzare la buona riuscita dell’esame diagnostico di emocoltura e che i fattori che possono diminuire i contaminanti sono: la scelta dell’accesso venoso adeguato, l’esperienza lavorativa, l’utilizzo della clorexidina come antisettico, il corretto volume di sangue nei flaconi di raccolta, l’essere costantemente informati sulla procedura, l’esecuzione dell’emocoltura da parte di un team di flebotomisti, l’utilizzo di un Kit specifico per emocoltura, l’adesione a procedure aziendali. Conclusioni. dalla revisione è emerso che non ci sono strategie comuni sulla corretta esecuzione dell’emocoltura, piuttosto una serie di procedure indicate per limitare le contaminazioni. Parola chiave. Emocoltura, sicurezza delle cure, “aderenza alle linee guida”, “bundle assistenziali”.
ABSTRACT ENG
Introduction. Blood culture represents the gold standard in the microbiological diagnosis of sepsis and/or fever of unknown origin. If done correctly, it is the best tool to manage the “sepsis phenomenon” in all possible manifestations. The purpose of the work is to conduct a literature review to highlight the good practices of blood cultures in hospitalized patients and prevent non-compliance. Methods. A literature review is conducted with the definition of the research question through the PICO formulation. The research was performed on three important databases, Pubmed, Scopus and Cochrane Library. Results. From the analysis of the data it emerged that there are many factors that can influence the success of the blood culture diagnostic examination and that the factors that can reduce the contaminants are: the choice of adequate venous access, work experience, use of chlorhexidine as an antiseptic, the correct volume of blood in the collection bottles, being constantly informed about the procedure, the blood culture carried out by a team of phlebotomists, the use of a specific kit for blood culture, the adherence to company procedures. Conclusions. It emerged that there are no common strategies on the correct execution of blood culture, instead a series of procedures indicated to limit contamination. Keywords. Blood culture, Patient Safety, “guideline adherence”, “patient care Bundles”, “bundles”.
INTRODUZIONE
L’emocoltura rappresenta il gold standard nella diagnosi microbiologica della sepsi e/o di febbre di origine ignota. Se eseguita correttamente è lo strumento migliore per gestire il “fenomeno sepsi” in tutte le possibili manifestazioni (APSI-SIMPIOS, 2019). Alcuni documenti come “Consensus position paper APSI sull’emocoltura nel paziente settico” e “Raccomandazioni APSI-SIMPIOS sull’emocoltura nel paziente settico, APSI-SIMPIOS”, riassumono i principi generali su questa metodica, partendo dall’esecuzione del prelievo fino ad aspetti relativi alla diagnosi di laboratorio. Questi documenti evidenziano, inoltre, le maggiori criticità che caratterizzano il processo diagnostico dell’emocoltura, utilizzando un approccio che ne permetta la possibilità di far emergere gli elementi tecnicamente irrinunciabili a garanzia della qualità, dell’appropriatezza e dell’efficienza delle scelte operate. Un esame di emocoltura eseguito senza un protocollo aziendale o senza il rispetto delle linee guida di categoria, oltre a influire sulla possibilità di ottenere una diagnosi errata per la determinazione del germe responsabile della setticemia, può essere motivo di costi elevati senza effettivamente il beneficio del risultato e creare un disagio per l’assistito che si ritrova a dover subire un prelievo senza poi avere la certezza di un risultato “vero positivo” e il ricorso ad una terapia antibiotica che non rispecchi i criteri di appropriatezza (raccomandazioni APSI-SIMPIOS, 2019; Rocchetti A. et Al, 2018). A livello internazionale, i tassi di contaminazione dei campioni di emocolture nei reparti di degenza sono stati rilevati tra il 2 e 3%, e molte strategie si possono attuare per poter rimanere entro i limiti o comunque di cercare di diminuirli (Hall et al, 2006). Tra le strategie attuabili rientrano: l’importanza della consegna dell’emocoltura in laboratorio entro le 4 ore dal prelievo per una incubazione precoce, l’utilizzo di manovre asettiche durante il prelievo, la disinfezione delle membrane dei flaconi prima di introdurre il campione di sangue, il riempimento dei flaconi con un volume non inferiore a 8 ml e non superiore ai 10 ml, la corretta identificazione del campione attraverso l’applicazione di etichette, l’esperienza dell’operatore nella pratica di emocoltura, il riempimento di almeno due flaconi di aerobi e due di anaerobi, il tempo di incubazione dei flaconi che non dovrebbe essere inferiore ai 5 giorni, il catetere vascolare può essere utilizzato per l’emocoltura solo quando vi è il dubbio che sia il catetere fonte di infezione (raccomandazioni APSI-SIMPIOS, 2019). Le emocolture erroneamente identificate come positive hanno un impatto significativo sull’aumento dei costi di degenza ospedaliera in quanto determinano un aumento dei giorni di degenza, degli esami di laboratorio aggiuntivi e di utilizzo improprio di farmaci per l’antibioticoterapia (Alahmadi et al, 2018). Al fine di innalzare lo standard della tecnica di esecuzione delle emocolture, migliorando così sia la qualità della cura del paziente che l’uso delle risorse (Alahmadi et al, 2018), è necessario evidenziare le good practice in relazione a tale metodica nei soggetti ospedalizzati e prevenire le non conformità. Da un’interessante indagine sulle metodiche di emocoltura in Italia del 2004 (Goglio A. at al, 2004) è emerso che il suo impatto sulla cura dell’utente, è condizionato da molteplici fattori fra cui principalmente il volume del campione, il momento del prelievo, l’intervallo ed il numero dei prelievi, l’accuratezza del prelievo (metodo di antisepsi della cute), le caratteristiche del mezzo di coltura, la durata dell’incubazione, la capacità del sistema analitico di evidenziare lo sviluppo batterico, l’interpretazione del risultato (patogeni vs contaminanti). Questa indagine ha fornito anche, utili informazioni per programmare iniziative di formazione e formulare linee guida, ai singoli microbiologi per confrontare le proprie prassi con quelle di altri colleghi, ai clinici per ottimizzare la richiesta dell’esame e il miglior uso dei risultati (Goglio A. at al, 2004). Uno dei punti critici emersi dall’indagine è stata la corretta indicazione ad effettuare l’emocoltura, che risulta essere ancora poco standardizzata negli ospedali italiani rispetto a quelli degli Stati Uniti D’America (USA). Un altro aspetto importante che si diversifica da ospedale a ospedale è relativo al volume di sangue per il riempimento dei flaconi, il numero di flaconi da inviare e i tempi di prelievo. L’indagine condotta in Italia ha evidenziato una sostanziale diffusa correttezza nell’esecuzione dell’emocoltura, con una buona adesione ai protocolli diagnostici prodotti dalle società scientifiche o agenzie sanitarie. Tuttavia, è emersa una lacuna relativa alle evidenze sulle indicazioni cogenti, mentre si trovano indicazioni non sempre concordanti sui tempi e il numero dei prelievi (Goglio A. at al, 2004). Per questi motivi, si è voluto condurre una revisione della letteratura con lo scopo di evidenziare le good practice nell’esecuzione delle emocolture nei soggetti ospedalizzati.
MATERIALI E METODI
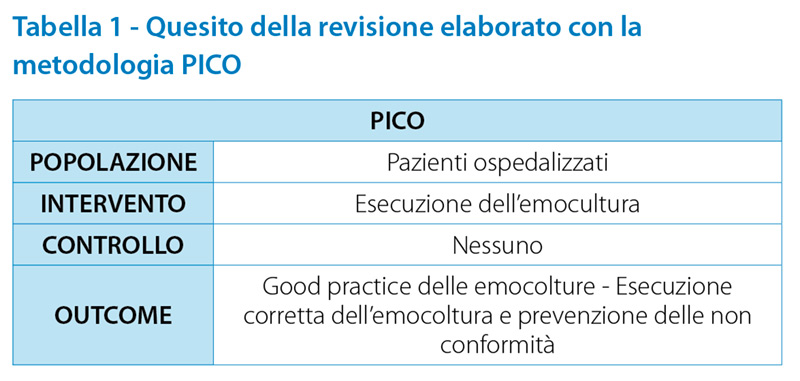
È stata condotta una revisione della letteratura con la definizione del quesito di ricerca attraverso la formulazione del PICO (tabella 1)
FONTE DEI DATI
La ricerca è stata eseguita su tre database, Pubmed, Scopus e Cochrane Library.
Sono stati utilizzati i seguenti termini di ricerca:
- blood culture,
- Patient Safet,
- “Guideline Adherence”[Mesh]
- “Patient Care Bundles”[Mesh]
- “contamination blood culture* e
- “Blood Culture”[Mesh].
La stringa di ricerca per Pubmed è stata: (((((“Patient Safety”[Mesh]) OR “Guideline Adherence”[Mesh]) OR “Patient Care Bundles”[Mesh]) OR “contamination blood culture*”)) AND “Blood Culture”[Mesh]. Per gli altri due database non sono stati utilizzati i termini Mesh ma le sole parole di testo libero. Dato che non sono presenti in letteratura revisioni sistematiche sull’argomento trattato, alla ricerca non si sono posti limiti temporali (fino a settembre 2019). Sono stati inclusi studi in lingua inglese o italiana.
SELEZIONE DEGLI STUDI
Gli articoli emersi dalla ricerca sulle banche dati scelte per questa revisione sono stati valutati in relazione allo scopo preposto dapprima sui titoli, poi gli abstract ed infine sui full-text. Questo processo è stato condotto in cieco da cinque revisori in cieco, arrivando così ad identificare gli articoli da includere nella revisione. Eventuali conflitti sono stati risolti attraverso consensus di tutti i ricercatori. Tutti i full text sono stati valutati in base allo scopo prefissato e ai criteri di inclusione/esclusione per identificare quelli eleggibili ai fini della revisione. Una volta selezionati gli articoli da includere nella revisione ha avuto luogo l’estrazione dei dati.
CRITERI DI INCLUSIONE ED ESCLUSIONE
Di seguito in tabella 2 riportiamo i criteri di inclusione e di esclusione degli articoli in esame.

RISULTATI
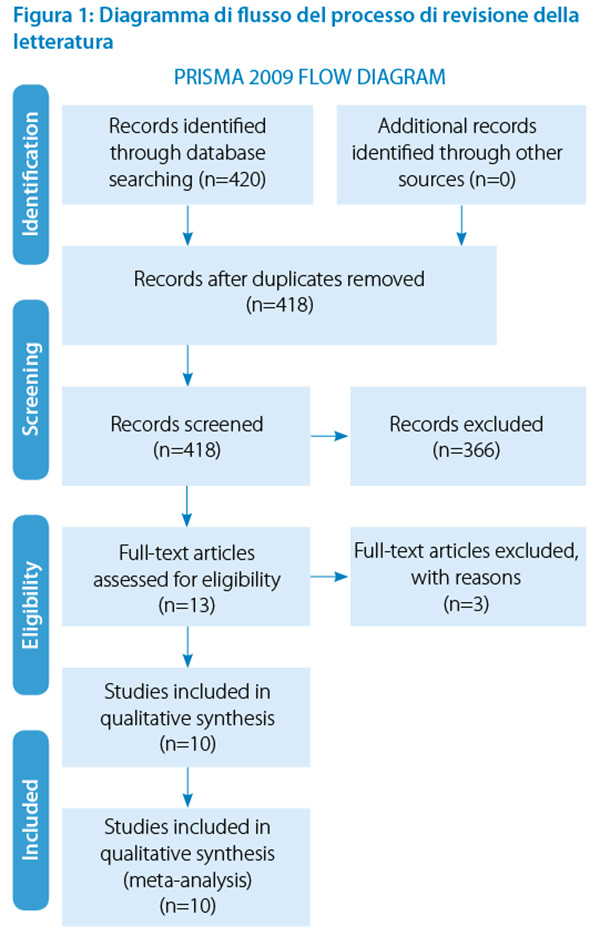
Il processo di revisione viene riportato schematicamente nel PRISMA Flow Diagram (figura 1). La ricerca bibliografica ha individuato 420 articoli, che dopo rimozione dei doppioni si è giunti a 418. Attraverso l’analisi dei titoli, ne sono stati eliminati 366, in quanto non pertinenti allo scopo preposto in questa revisione. Sono stati letti 52 abstract, scartandone 37 perché non inerenti allo scopo specifico della revisione condotta. Di questi abstract, 19 sono stati eliminati poiché condotti sulla popolazione pediatrica, 13 si occupavano della terapia dei germi riscontrati nelle emocolture e i restanti 5 prendevano in considerazione solo una tecnica particolare di emocoltura valutandone l’efficacia. Sono stati, pertanto, richiesti i full text dei 15 abstract selezionati. Di questi 15 articoli solo 10 si sono ritenuti validi ai fini della revisione della letteratura, 1 eliminato perché protocollo di ricerca, 1 eliminato perché trattava di urinocolture e 3 eliminati perché trattavano di una popolazione pediatrica.
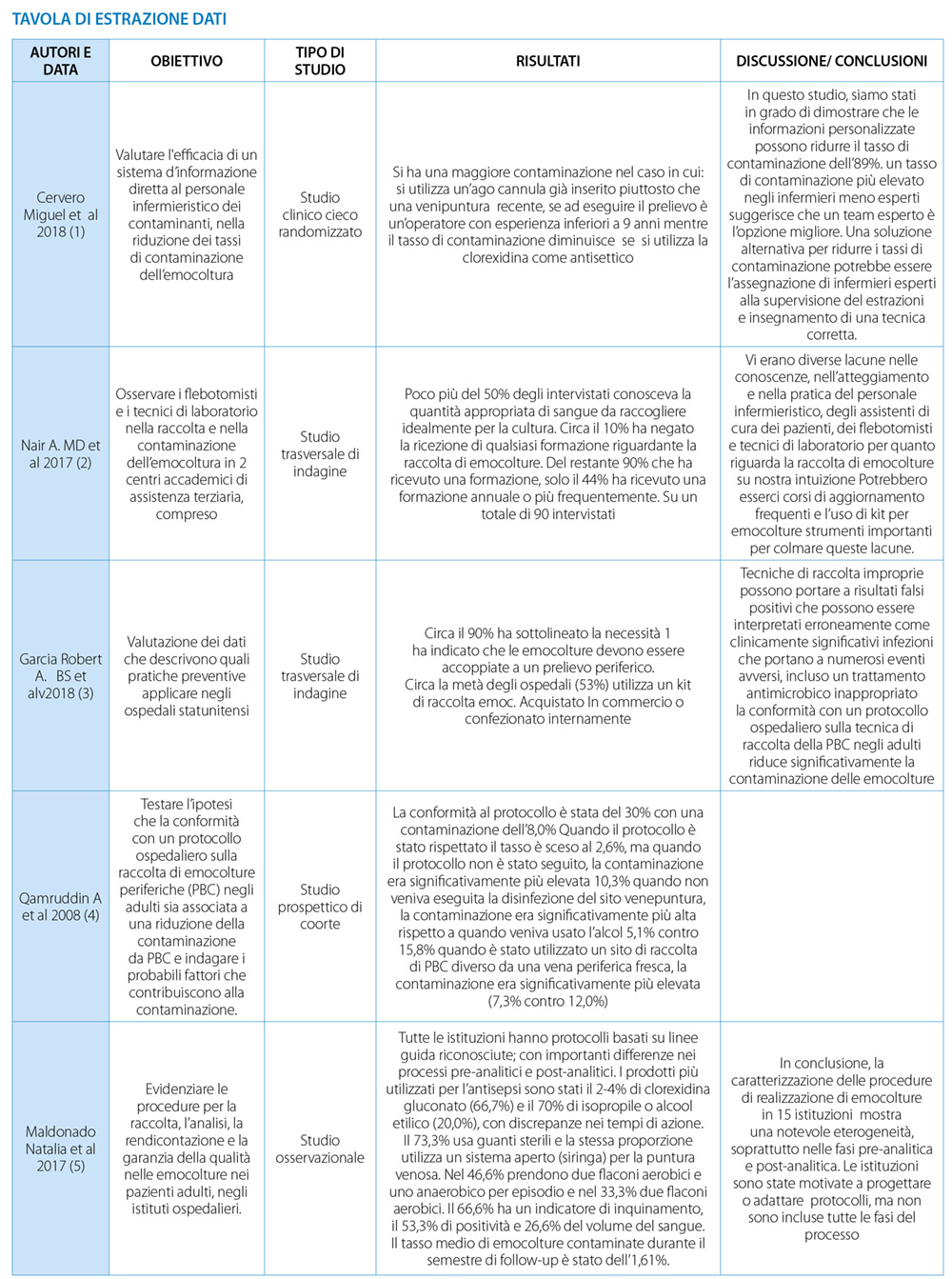
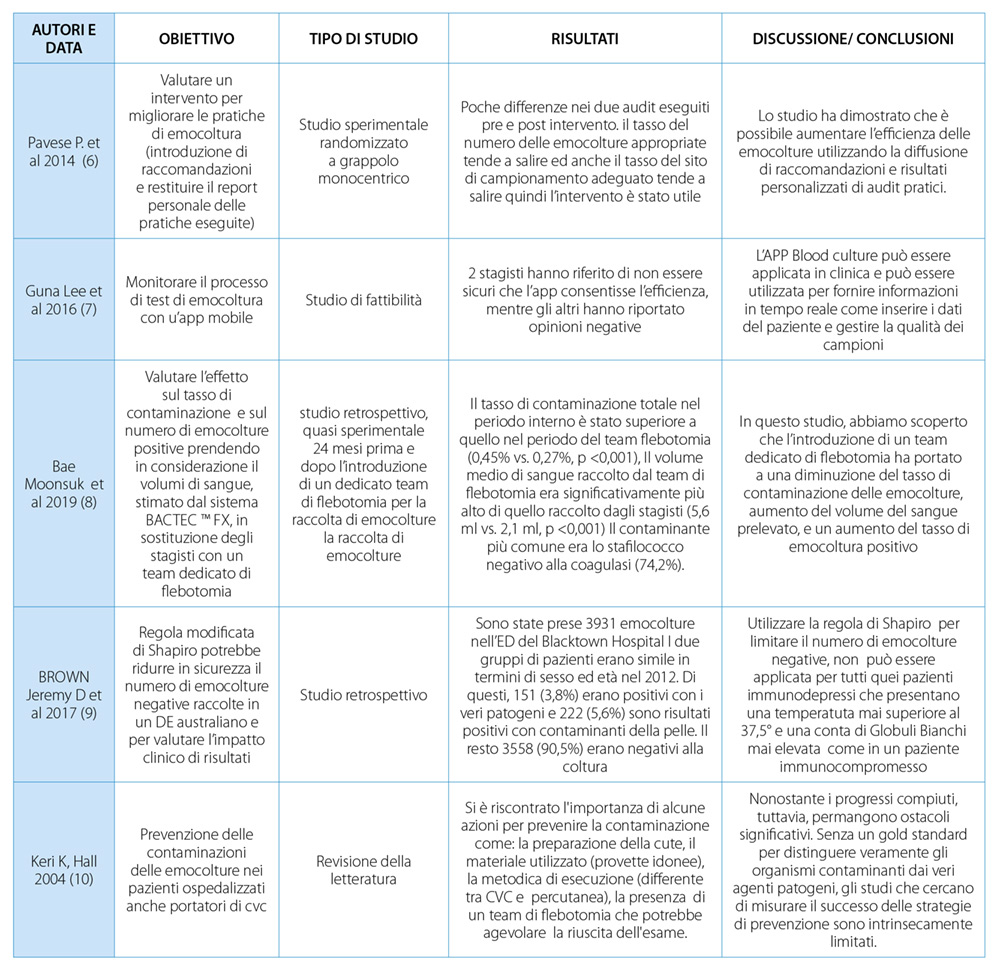
Tutti gli articoli hanno evidenziato varie strategie di buona pratica assistenziale nell’esecuzione delle emocolture e le principali sono relative alla metodica di prelievo, come da quale accesso venoso eseguire il campionamento di sangue, la scelta del disinfettante cutaneo e l’utilizzo di kit preconfezionati, e al personale che esegue la procedura, con focus su team dedicati, anni di esperienza e corsi di formazioni dedicati alla tematica.
Accesso venoso
Negli articoli di Cervero (2018), Garcia (2018), Qamruddin (2008) e Pavese (2014) viene analizzato la tipologia di accesso venoso da cui eseguire il prelievo dell’emocoltura. Gli studi sottolineano l’importanza di eseguire il prelievo dell’emocoltura preferibilmente da un dispositivo vascolare posizionato da poco tempo o, ancora meglio, da nuova venipuntura periferica , piuttosto che da catetere venoso centrale (CVC Cervero M. et al, 2018; Qamruddin A. et al, 2008). Infatti, se si esegue il campionamento di sangue da un dispositivo vascolare posizionato da più giorni, aumenta il rischio di contaminazione del prelievo ( Garcia R.A. et al, 2018). Nel caso in cui venga ipotizzato che la fonte di infezione di un paziente sia un CVC, allora è fortemente raccomandato il prelievo da CVC e contestualmente anche da vena periferica per l’esecuzione della diagnosi differenziale (Pavese et al, 2014).
Utilizzo di clorexidina come antisettico cutaneo
Per la corretta esecuzione dell’emocoltura è inoltre, necessario eseguire l’antisepsi cutanea e/o la disinfezione dei punti di raccordo dell’accesso venoso. Questa raccomandazione è emersa dagli articoli di Cervero M. (2018), Maldonado N (2017) e Qamruddin A. (2008). In particolare, in questi studi viene evidenziato che l’utilizzo della clorexidina al 2% su base alcolica per l’antisepsi della cute permette di eseguire correttamente l’antisepsi cutanea e la disinfezione dei punti di raccordo dell’accesso venoso, riducendo così la possibilità di contaminare il prelievo. A sostegno di tale raccomandazione è presente anche una revisione della letteratura condotta da Keri K. (2006), riportando che una buona decontaminazione della cute permetta di ottenere minori contaminazioni.
Volume di sangue
Un ulteriore aspetto che è emerso dagli articoli inclusi nella revisione della letteratura riguarda il volume di riempimento dei flaconi per eseguire l’emocoltura. Questa tematica viene affrontata negli articoli di Nair A. (2017) e di Brown J.D. (2017) Nei due studi, infatti, è emerso che solo la metà degli infermieri che eseguiva il prelievo dell’emocoltura era a conoscenza del corretto volume di riempimento. Il corretto campionamento di sangue influisce sul risultato “a buon fine” dell’emocoltura, inteso come l’identificazione del patogeno che causa la sepsi della persona assistita. Per colmare questo gap, nell’articolo di Nair A.(2017) è stato valutato l’impatto di un team di flebotomisti dedicato all’esecuzione dell’emocoltura. Nello studio è emerso che il team dedicato, raccogliendo il quantitativo necessario di sangue utile all’identificazione del germe responsabile della batteriemia, ha ottenuto un numero superiore di emocolture positive rispetto al personale non specializzato. Dallo studio di Brown (2017) inoltre è risultata una notevole discrepanza tra le diagnosi eseguite in Pronto Soccorso rispetto alle diagnosi di dimissione.
Kit per emocoltura
Un ulteriore strategia per garantire una buona esecuzione dell’emocoltura è rappresentata dalla composizione e utilizzo di un kit standard per questa procedura. Uno studio condotto da Nair A. (2017) evidenzia le lacune di tutti i professionisti interessati alla pratica dell’emocoltura e suggerisce l’utilizzo di un kit per emocoltura. Avere a disposizione il materiale sembrerebbe che diminuisca il rischio di errore e di non rispettare i passaggi fondamentali, come la corretta antisepsi cutanea e l’utilizzo di materiali sterili. Dall’articolo di Garcia (2018) si evidenzia, inoltre, che più della metà degli ospedali presi in considerazione per l’emocoltura utilizzano un kit che confezionano all’interno della loro struttura, con una diminuzione del numero dei contaminanti.
Corsi di formazione ed esperienza lavorativa
In molti articoli si evidenzia come l’esperienza lavorativa sia strettamente legata alla buona pratica dell’emocoltura, definendo con esperienza un’anzianità lavorativa di almeno 9 anni (Cervero M. et al, 2018; Pavese et al 2014, Nair A. MD et al 2017). L’articolo di Nair (2017) ha rilevato che vi erano diverse lacune nelle conoscenze, nell’atteggiamento e nell’esecuzione del personale infermieristico sulla pratica dell’emocoltura e che più del 44% dei reclutati allo studio non avesse ricevuto formazione nell’ultimo anno. Queste lacune sembrerebbero colmarsi con interventi educativi, come audit e corsi per promuovere le raccomandazioni, come sottolineato nell’articolo di Pavese (2014). Nello studio appena citato, infatti, sono state implementate strategie aziendali per la corretta esecuzione dell’emocoltura, dimostrando sia il miglioramento del numero di emocolture eseguite correttamente che la scelta di un campionamento adeguato, oltre che alla riduzione di campioni contaminati (Pavese R. et al., 2014).
Protocollo aziendale
Oltre gli audit e corsi di formazione specifici, è emerso che la diffusione di un protocollo aziendale sull’emocoltura rappresenti un ulteriore punto di forza per la corretta esecuzione della procedura. Nell’articolo di Maldonado (2017) si mette in evidenza la diversità dei protocolli aziendali sulla corretta pratica dell’emocoltura, con differenze importanti nella parte pre-analitica e post-analitica. Sensibilizzare il personale infermieristico alla visione ed attuazione di protocolli aziendali specifici diminuisce il rischio di difformità in relazione ai passaggi della procedura, diminuendo il numero di prelievi contaminati (Qamruddin A et al, 2008).
Team di flebotomisti
Nei setting assistenziali anglo-americani è diffusa la pratica di suddivisione dei compiti lavorativi, dedicando e specializzando il personale infermieristico per ogni aspetto assistenziale. In particolare, nell’articolo di Cervero (2018) viene valutata l’introduzione della figura di un team di flebotomisti per la somministrazione della terapia endovenosa e l’esecuzione delle emocolture. Nello studio è emerso che il team riduce il tasso dei contaminanti delle emocolture (Cervero M., et al., 2018). Questo dato viene anche confermato nello studio di Bae M. et al. (2019). Nell’articolo di Nair (2017), oltre all’implementazione del team per l’esecuzione delle emocolture, viene evidenziato come questo personale sia preparato a livello teorico e pratico.
DISCUSSIONI
La revisione della letteratura condotta ha avuto lo scopo di evidenziare le good practice nell’esecuzione delle emocolture nei soggetti ospedalizzati e ha evidenziato tutti gli aspetti fondamentali per eseguirla correttamente e rendere affidabile il campione di emocoltura idoneo per la determinazione del germe patogeno. Emergono, innanzitutto, notevoli discrepanze nell’esecuzione della tecnica che avrebbe dovuto essere da tempo, standardizzata in ogni sua parte. Sono state evidenziate delle tematiche fondamentali nella parte pre-analitica (Maldonado N. et al, 2017), ovvero relative al campionamento da parte del personale. Queste sono identificabili nella scelta dell’antisettico (Cervero M. 2018, Maldonado N 2017, Qamruddin A. 2008), nel quantitativo di volume di sangue per flacone (Nair A. 2017 e di Brown J.D. 2017), nell’utilizzo di equipe formate e esperte (Cervero M., et al., 2018, Bae M. et al. 2019). nella formazione continua e nella presenza di protocolli aziendali (Cervero M. et al, 2018; Pavese et al 2014, Nair A. MD et al 2017). Queste tematiche sono state affrontate in tutti gli articoli inclusi nella revisione che è stata condotta ed incidono sulla fase post-analitica, relativa all’identificazione dei patogeni, che si diversificano da ospedale a ospedale, ma che non sono state analizzate in quanto non argomento della presente revisione della letteratura.
È fondamentale che venga standardizzata la procedura dell’emocoltura sia nella fase pre-analitica che post analitica, per ridurre le deviazioni dalle best practice e garantire un campionamento idoneo, efficace ed efficiente, in termini di identificazione del patogeno (Hall at al, 2006, Maldonado N. et al, 2017).
- Gli studi presi in considerazione ci indicano come antisettico ideale per le venipunture la clorexidina al 2% su base alcolica, riducendo così il numero dei contaminanti
- Un ulteriore raccomandazione per eseguire correttamente un’emocoltura è il riempimento dei flaconi di un volume di sangue idoneo all’interno dei flaconi, se sono raccomandati dagli 8-10 ml per flacone, è bene non riempire in eccesso e neanche in difetto perché l’esito potrebbe risultare di conseguenza, un falso positivo o un falso negativo.
- Di notevole importanza riveste anche la scelta di eseguire il campionamento da un nuovo accesso venoso. Infatti, prelevare un accesso vascolare di nuovo inserimento, diminuisce notevolmente la possibilità di avere dei contaminati (Cervero M., et al., 2018; Qamruddin A. et al., 2008).
- Un altro aspetto che influisce sull’esecuzione dell’emocoltura è relativo al personale che esegue la procedura. In molti articoli si parla di personale con anni di esperienza e di un team di flebotomisti, che sono di fatto degli esperti nell’esecuzione corretta della procedura (Bae M. et al. 2019, Cervero M., et al., 2018); questa figura professionale sviluppatasi maggiormente nel nord Europa che, a seguito di un corso di formazione, si occupa della somministrazione della terapia infusionale, dei prelievi ematici ed anche delle emocolture. L’avere infermieri dedicati ci porta a avere a disposizione personale con notevoli capacità tecniche ed abilità nel prelevare campioni di sangue in modo rapido, efficiente e sicuro, diventando parte integrante del team sanitario. L’utilizzo di questa figura, grazie alla sua capacità ed esperienza preleva un idoneo campione di sangue per l’esame dell’emocoltura, seguendo le linee guida e protocolli specifici, diminuendo in modo significativo il numero dei contaminanti (Bae M., et al, 2019).
- Così come anche la formazione che è risultata essere un valore unico e indispensabile nel diminuire il numero dei contaminanti (Nair A. MD et al, 2017, Pavese et al, 2014)
Limiti della presente revisione sono stati il prendere in considerazione solo articoli in lingua italiana e inglese o che trattavano di studi condotti sulla popolazione pediatrica. Gli articoli esaminati erano piuttosto eterogenei, sia a livello metodologico sia nei risultati emersi, ponendo difficoltà nella valutazione dei risultati stessi. Queste diversità non hanno reso possibile in alcune situazioni mettere a confronto i dati ottenuti. Ciò ha influito notevolmente sull’identificazione finale delle best practice da seguire per eseguire correttamente un’emocoltura.
CONCLUSIONI
Lo scopo di questa revisione era evidenziare le good practice nell’esecuzione delle emocolture nei soggetti ospedalizzati, questo dato poi potrebbe essere utilizzato per poter studiare delle pratiche comuni nel territorio nazionale. La revisione ha sottolineato la presenza di alcune problematiche, prima tra tutte relative alle conoscenze del personale infermieristico che è responsabile dell’esecuzione della procedura. Studi futuri dovrebbero approfondire tale tematica ed approfondire anche interventi per migliorare l’esecuzione dell’emocoltura. Sarebbe opportuno, infine, che i professionisti infermieri abbiano come riferimento delle linee guida internazionali e un protocollo aziendale per standardizzare questa procedura e garantire agli assistiti una cura sicura, efficace, efficiente ed appropriata.
BIBLIOGRAFIA
- Alahmadi, Y.M. et al. (2011) Clinical and economic impact of contaminated blood cultures within the hospital setting Journal of Hospital Infection, Volume 77, Issue 3, 233 – 236
- Alfandari S, Cabaret P, Nguyen S, Descamps D, Vachée A, Cattoen C, Van Grunderbeeck N (2016) Evaluating the management of 493 patients presenting with bacteremia in 23 northern French hospitals ARMEDA bacteremia groups. Med Mal Infect. Jun;46(4):194-9.
- Bae M, In Kim H, Park JH, Ryu BH, Chang J, Sung H, Jung J, Kim MJ, Kim SH, Lee SO, Choi SH, Kim YS, Woo JH, Kim MN, Chong YP. Eur J (2019) Improvement of blood culture contamination rate, blood volume, and true positive rate after introducing a dedicated phlebotomy team Clin Microbiol Infect Dis.
- Başustaoğlu A, Süzük Yıldız S, Mumcuoğlu İ, Karahan ZC, Öğünç D, Kaleli İ, Kurşun Ş, Evren E, Özhak Baysal B, Demir M, Murray P. Mikrobiyol Bul. [Evaluation of blood culture practices: Use of system (Epicenter) data] (2019) Jan;53(1):12-21. doi: 10.5578/mb.67782.
- Blaschke AJ, Shapiro DJ, Pavia AT, Byington CL, Ampofo K, Stockmann C, Hersh AL. J A (2014) National Study of the Impact of Rapid Influenza
- Testing on Clinical Care in the Emergency Department Pediatric Infect Dis Soc. Jun;3(2):112-8. doi: 0.1093/jpids/pit071. Epub 2013 Nov 13.
- Brown JD, Chapman S, Ferguson PE. (2017) Emerg Med Australas. Blood cultures and bacteraemia in an Australian emergency department: Evaluating a predictive rule to guide collection and their clinical impact; 29(1):56-62. doi: 10.1111/1742-6723.12696. Epub 2016
- Huang QH, Lin YC, Huang WS. Hu Li Za Zhi. [Reducing Blood Culture Contamination Rates in the Emergency Department] (2018);65(5):89-97.
- Cervero M, Quevedo S, Del Álamo M, Del Valle P, Wilhelmi I, Torres R, Agud JL, Alcázar V, Vázquez S, García B. (2019) Rev Esp Quimioter. Efficacy of an information system addressed to nursing staff for diminishing contaminated blood cultures: a blind clinical trial Apr;32(2):130-136. Epub
- Garcia RA, Spitzer ED, Kranz B, Barnes S. (2018 May) A national survey of interventions and practices in the prevention of blood culture contamination and associated adverse health care events Am J Infect Control.;46(5):571-576. doi: 10.1016/j.ajic.2017.11.009. Epub
- Goglio A., Nicoletti P., (2004) Indagine nazionale sulle metodiche per emocoltura in Italia volume 9, numero 1, emocolture in Italia
- Horowitz HW (2016 May) Infection control II: A practical guide to getting to zero Am J Infect Control. 2016 Sep 1;44(9):1075-7. doi: 10.1016/j.ajic.2016.02.032. Epub 5. No abstract available. PMID: 27158090
- Hughes JA, Cabilan CJ, Williams J, Ray M, Coyer F. (2018 Nov) The effectiveness of interventions to reduce peripheral blood culture contamination in acute care: a systematic review protocol Syst Rev. 30;7(1):216. doi: 10.1186/s13643-018-0877-4.
- Keri K, and Jason A Lyman. (2006) “Updated review of blood culture contamination.” Clinical microbiology reviews vol. 19,4
- Lee G, Lee Y, Chong YP, Jang S, Kim MN, Kim JH, Kim WS, Lee JH. J (2016 Oct) Blood Culture Testing via a Mobile App That Uses a Mobile Phone Camera: A Feasibility Study Med Internet Res. 26;18(10):e282.
- Nair A, Elliott SP, Al Mohajer M. Knowledge, (2017 May) attitude, and practice of blood culture contamination: A multicenter study Am J Infect Control. 1;45(5):547-548. doi: 10.1016/j.ajic.2017.01.008. Epub 2017 Feb 15.
- Ombelet S, Barbé B, Affolabi D, Ronat JB, Lompo P, Lunguya O, Jacobs J, Hardy L. Front Med (Lausanne) (2019) Best Practices of Blood Cultures in Low- and Middle-Income Countries 2019 Jun 18;6:131. doi: 10.3389/fmed.2019.00131. e Collection. Review.
- Pavese P, Maillet M, Vitrat-Hincky V, Recule C, Vittoz JP, Guyomard A, Seigneurin A, François P. Eur J (2014 Jul) Evaluation of an intervention to improve blood culture practices: a cluster randomised trial Clin Microbiol Infect Dis. Dec;33(12):2207-13. doi: 10.1007/s10096-014-2154-3. Epub 2.
- Qamruddin A, Khanna N, Orr D. J Clin Pathol. (2008) Peripheral blood culture contamination in adults and venepuncture technique: prospective cohort study Apr;61(4):509-13. Epub 2007 Aug 30.
- Raccomandazioni APSI-SIMPIOS sull’emocoltura nel paziente settico, APSI-SIMPIOS (24 Jul 2019) recommendations on the blood culture in septic patients, Il Pensiero Scientifico Editore downloaded by IP 130.25.79.163 Wed, , 16:41:01
- Rocchetti A., Sambri V. e Farina C. (2014– 2018) gruppo di lavoro APSI ector Referral Strategy “Consensus position paper APSI sull’emocoltura nel paziente settico”, Nairobi, Kenya
- Valley Natalia MaldonadoCarlos RobledoMaria MuneraMaria MuneraShow all 12 authorsJaime RobledoJaime Robledo (March 2018)
- Characterization of procedures for performing blood cultures in adult patients, in hospitals of the Metropolitan Area of Aburrá Infectio 22(1):19-25 DOI: 10.22354/in.v0i0.700 LicenseCC BY-NC-ND
Sonia Bustreo
Infermiera Specialista Rischio Infettivo, ASST-Ovestmi Ospedale di Magenta
RN, “ASST-Ovestmi” Magenta Hospital, Italy
sonia.bustreo@gmail.com
Silvia Camelo
Infermiera Strumentista, Sala Operatoria, Ospedale Sant’Omero, Teramo
RN, Operating Room, Sant’Omero Hospital, Teramo, Italy
Serena Tucci
Infermiera Pediatrica, Ospedale Pediatrico Bambino Gesù, Roma
RN, Bambino Gesù Children’s Hospital, Rome, Italy
Giovanna Cocco
Coordinatore Infermieristico, Dipartimento delle Dipendenze Patologiche Ser.D Anzio/Pomezia, ASL Roma
RN, “Dipartimento delle Dipendenze Patologiche Ser.D”, Anzio/Pomezia, “ASL” of Rome 6, Italy
Silvia Zenobi
Infermiera Strumentista, Sala Operatoria, Ospedale Sant’Omero, Teramo
RN, Operating Room, Sant’Omero Hospital, Teramo, Italy
Jacopo Fiorini

