30 Nov La gestione del paziente sottoposto alla tecnica dell’addome aperto: una revisione della letteratura
The management of the patient with an open abdomen: a literature review
RIASSUNTO
Contesto. La tecnica dell’addome aperto è definita come l’intenzionale mantenimento della cavità addominale diastasata, riservando la sintesi del peritoneo parietale e della fascia dei muscoli retti in un secondo tempo. Questa metodica viene utilizzata in ambito chirurgico in quei pazienti traumatizzati e/o settici che necessitano di un intervento rapido, in quanto emodinamicamente instabili. Lo scopo di questo studio è quello di approfondire, analizzare e confrontare gli interventi di assistenza infermieristica per la gestione del paziente adulto sottoposto alla tecnica chirurgica di Open Abdomen.
Metodi. È stata eseguita una ricerca bibliografica attraverso la consultazione delle banche dati PubMed, JBI, Scopus ed EMBASE.
Risultati. Nonostante gli importanti progressi e il perfezionamento delle tecniche di gestione nel campo della rianimazione del paziente sottoposto ad addome aperto, esso è ancora associato ad elevata morbilità e mortalità. Una gestione scrupolosa e fedele alle prove di efficacia permette, tuttavia, di prevenire le complicanze e garantisce la sopravvivenza del paziente. Conclusioni. Il paziente con addome aperto è a rischio di molteplici complicanze: compito dell’infermiere è prevenirle e riconoscerle precocemente per permettere una gestione ottimale delle stesse. Esistono ancora molti punti di discussione dovuti alla complessità di realizzare studi con elevato livello di evidenza. Le cause di tale complessità sono riconducibili alla ridotta numerosità dei campioni, alla eterogeneità della popolazione trattata e alla difficoltà di standardizzare le procedure.
Parole chiave. Addome aperto, laparotomia, laparostomia, cura delle ferite, gestione delle medicazioni, chirurgia addominale, infermiere, assistenza infermieristica, tecniche, terapia intensiva, monitoraggio, fistola enteroatmosferica, sepsi, ipertensione intra-addominale, sindrome compartimentale addominale, medicazione della ferita a pressione negativa.
ABSTRACT
Background. Open abdomen (OA) technique is defined as the intentional maintenance of the diastased abdominal cavity, reserving the synthesis of the parietal peritoneum and the fascia of the rectus muscles at a later time. This method is used in surgery in those traumatized and/or septic patients who require rapid intervention, as they are hemodynamically unstable. The aim of this study was to analyze and compare nursing care interventions for the management of the adult patient undergoing to the open abdomen surgical technique. Methods. A bibliographic research was performed by consulting the PubMed, JBI, Scopus and EMBASE. Results. Despite important advances and refinements of management techniques of resuscitation of the patient undergoing OA, it’s still associated with high morbidity and mortality. A scrupulous management and faithful to the evidence of efficacy allows, however, to prevent complications and guarantees the survival of the patient. Conclusions. Patient with OA risks multiple complications: the nurse’s task is to prevent them and recognize them early to allow for optimal management of the same. There are still many points of discussion due to the complexity of carrying out studies with a high level of evidence. The causes of this complexity are attributable to the reduced number of samples, the heterogeneity of the population treated and the difficulty of standardizing the procedures. Key words. Open abdomen, laparotomy, laparostomy, wound care, wound management, abdominal surgery, nurse, nursing, techniques, critical care, monitoring, enteroatmospheric fistula, sepsis, intra-abdominal hypertension, abdominal compartment syndrome, negative pressure wound therapy.
INTRODUZIONE
“La tecnica dell’open abdomen (OA) è definita come l’intenzionale mantenimento della cavità addominale diastasata, riservando la sintesi del peritoneo parietale e della fascia dei muscoli retti in un secondo tempo. Di conseguenza, il contenuto addominale è esposto, ma protetto da una copertura provvisoria, posta al termine della procedura chirurgica. Questa tecnica è il cardine del trattamento per le infezioni e il sanguinamento intra-addominali e la sindrome compartimentale addominale (ACS), qualunque sia la causa, per consentire al viscere danneggiato o edematoso di espandersi, riducendo in questo modo la pressione intra-addominale (IAP) e le relative complicanze.” (Fitzpatrick, 2017)
“L’OA consente una riesplorazione pianificata. Sebbene esso sia efficace, è associato a gravi complicazioni, come la perdita di liquidi e proteine, che può produrre insufficienza nutrizionale e uno stato catabolico, perdita del dominio addominale da retrazione fasciale e sviluppo di un’enorme ernia ventrale qualora non venisse effettuata una chiusura precoce.” (Chiara, 2016)
La letteratura sull’OA è ancora carente di studi primari e una sintesi narrativa della letteratura esistente potrebbe agevolare la comprensione dello stato dell’arte delle evidenze disponibili, indentificando gli interventi di assistenza infermieristica supportati da evidenze e quelli da indagare ulteriormente.
Addizionali ricerche empiriche andrebbero condotte sulle seguenti aree: nutrizione, mobilizzazione, cura di sé e supporto psicologico del paziente e dei membri dell’équipe.
OBIETTIVO DELLO STUDIO
Lo scopo di questo studio è quello di approfondire, analizzare e confrontare gli interventi di assistenza infermieristica per la gestione del paziente adulto sottoposto alla tecnica chirurgica di Open Abdomen in seguito a evento traumatico o patologia acuta, al fine di evitare complicanze e favorire la guarigione nel minor tempo possibile.
METODI
Disegno
Revisione narrativa della letteratura.
Strategia di ricerca
È stato utilizzato l’approccio PIO:
- P: paziente con addome aperto in rianimazione
- I: gestione infermieristica
- O: prevenzione delle complicanze e outcome favorevole
Sono state utilizzate le seguenti parole chiave per la ricerca: open, laparotom, laparostom, abdomen, nurse, nursing.
Per combinare queste parole chiave tra di loro, sono stati utilizzati gli operatori booleani AND e OR.
Report di ricerca:
Sono stati contattati diversi centri di riferimento traumatologici italiani, ed uno di questi internazionale:
- Trauma Center dell’AUSL Romagna “M. Bufalini”, Cesena
- Ospedale San Gerardo, Monza
- Grande Ospedale Metropolitano Niguarda, Milano
- “R Adams Cowley Shock Trauma Center”, Baltimora
Criteri di eleggibilità
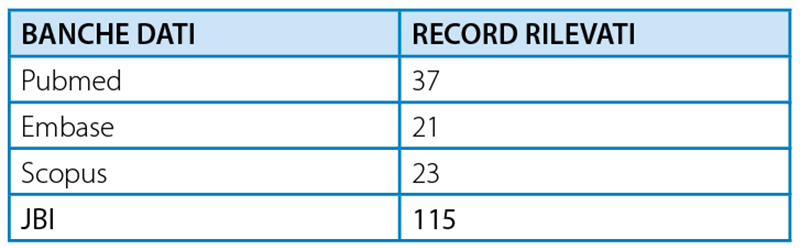
Sono state consultate le seguenti banche dati internazionali: Pubmed, Embase, Scopus e JBI.
Tutti gli studi che includevano pazienti ospedalizzati, di età pari o superiore a 18 anni, sottoposti a laparotomia, indipendentemente dall’indicazione o dal sesso, e che non erano in grado di raggiungere la chiusura fasciale primaria alla fine dell’operazione iniziale, erano eleggibili per l’inclusione.
Selezione degli studi
Sono stati applicati i seguenti criteri di inclusione:
- letteratura disponibile in lingua italiana, inglese e francese
- limiti temporali di pubblicazione degli articoli: ultimi 10 anni (dal 2011 al 2021)
- specie umana
- popolazione 18 anni
Sono stati applicati i seguenti criteri di esclusione:
- popolazione 18 anni
- articoli che trattano argomenti non inerenti col presente elaborato.
RISULTATI
Selezione degli studi
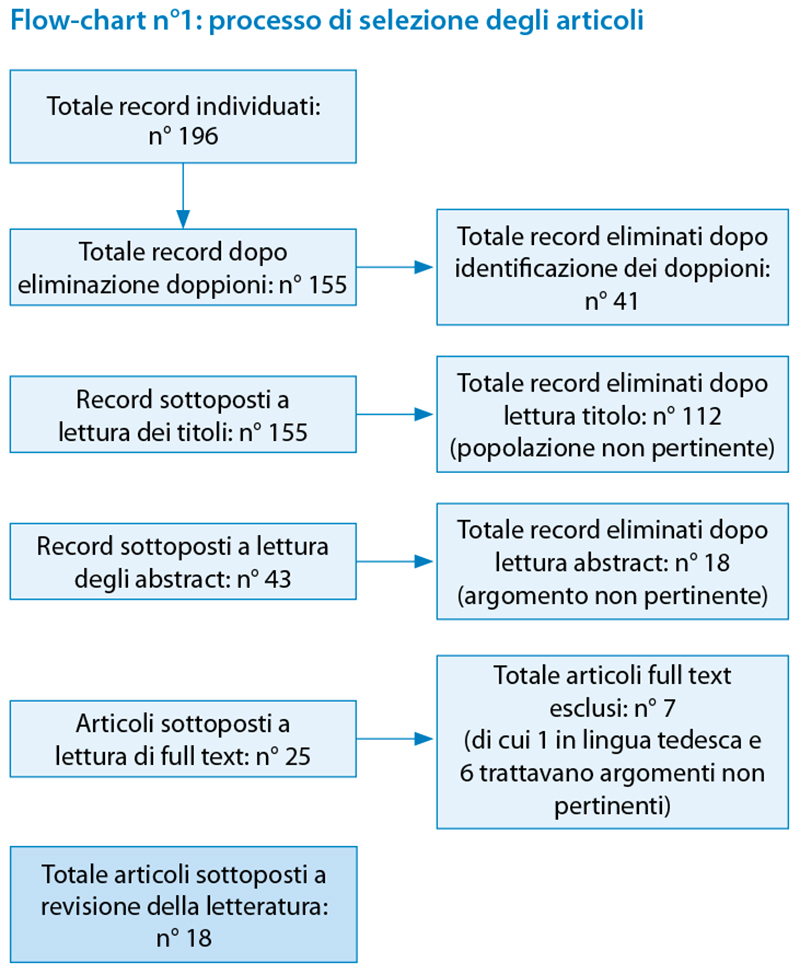
La ricerca bibliografica ha prodotto 196 record selezionati dalle varie banche dati (Pubmed, Embase, Scopus, JBI). In un primo passaggio sono stati eliminati tutti i doppioni, che hanno portato all’esclusione di 41 record. È stata fatta una seconda selezione mediante lettura dei titoli, che ha portato all’eliminazione di 112 record, in quanto includevano popolazioni di soggetti non facenti parte dei criteri di inclusione del presente elaborato. Successivamente, sono stati analizzati gli abstract dei restanti 43 record, dei quali ne sono stati esclusi 18 in quanto non pertinenti con il tema trattato. Dei rimanenti 25 record, 22 erano disponibili in formato full text gratuito in formato digitale, mentre 3 sono stati richiesti alla biblioteca dell’Università Statale di Milano in formato cartaceo. Dopo lettura e analisi dei full text completi, sono stati eliminati 7 articoli in quanto trattavano argomenti fuorvianti rispetto al presente elaborato. Al termine del processo di selezione, sono stati ritenuti pertinenti e sottoposti a revisione della letteratura un totale di 18 articoli. (flow-chart n°1)
Flow-chart n°1: processo di selezione degli articoli
Sintesi dei risultati
1. Ventilazione meccanica: non sono rintracciabili negli studi utilizzati le metodiche di ventilazione meccanica più appropriate, ma Fitzpatrick nell’articolo “Open Abdomen in Trauma and Critical Care” (2017) elenca i principali interventi infermieristici che è necessario svolgere per una buona gestione della ventilazione in un paziente con addome aperto, essi sono:
- “ottenere risultati dell’emogasanalisi e interpretarli;
- adattare le impostazioni del ventilatore;
- effettuare i cambi di postura;
- aspirare le secrezioni tracheobronchiali.”
2. Monitoraggio della pressione intra-addominale: come confermato da Munn nell’articolo “Burns patients: abdominal compartment syndrome” (2021), “la misurazione della IAP è essenziale nei pazienti critici a rischio di IAH/ACS (Grado 1B) e dovrebbe essere misurata ogni 12 ore e ogni 4-6 ore una volta che è stata rilevata IAH/ACS o se si verifica un’insufficienza d’organo.” (Coccolini, 2018b)
“La gestione di IAH e ACS si basa su misurazioni seriali di IAP. Dolore, brividi, agitazione, uso di muscoli accessori e mancata sincronicità del ventilatore aumentano il tono muscolare della parete addominale, un importante determinante della compliance della parete addominale. La risoluzione di questi problemi dovrebbe aumentare la compliance della parete addominale e aiutare ad adattare un dato volume intra-addominale a una IAP inferiore.
La IAP viene misurata correttamente in un paziente supino senza contrazioni muscolari addominali attive con il trasduttore azzerato sulla linea ascellare media. L’elevazione della testata del letto a 30° dalla posizione supina aumenta la IAP di 1.5-5.2 mmHg. Se è necessaria la posizione prona, è consigliabile mantenere l’addome in sospensione.
Il blocco neuromuscolare (NMB) può essere utilizzato per ridurre la IAP a breve termine.” (Padar, 2019)
“La misurazione della IAP normalmente viene eseguita tramite il catetere urinario. Viene comunemente utilizzato un kit composto da un catetere Foley, un rubinetto a tre vie e un trasduttore di pressione collegato a un monitor nell’unità del letto.
Il sistema deve essere chiuso, avere un punto di riferimento fisso (linea ascellare media), volume di instillazione standard e registrazione standardizzata (come la posizione del corpo e la fase respiratoria). La IAP dovrebbe essere misurata a fine espirazione.” (Munn, 2021)
Fitzpatrick (2017) fornisce un elenco dettagliato di interventi infermieristici da svolgere durante la presa in carico di un paziente a rischio di IAH:
- “valutare i segni precoci di IAH: diminuzione della GC e della PA, oliguria, aumento della pressione inspiratoria di picco, ipercapnia e ipossia;
- ripetere le misurazioni ogni 2-4 ore in pazienti con IAP ≥12 mmHg in modo che possano essere stabilite tendenze e aumenti di pressione e vengano rilevati aumenti potenzialmente pericolosi di IAP, IAH e ACS.”
3. Nutrizione: “l’evacuazione dell’essudato peritoneale deve essere misurata al fine di regolare le integrazioni nutrizionali.
L’alimentazione orale non è controindicata e dovrebbe essere utilizzata ove possibile. (Grado 2C)
La nutrizione enterale (NE) che inizia entro le prime 24-48 ore migliora la guarigione delle ferite e il tasso di chiusura fasciale, diminuisce il catabolismo, riduce la frequenza di polmoniti e fistole, preserva l’integrità del tratto gastrointestinale e infine riduce le complicanze, la durata della degenza ospedaliera e i costi; essa dovrebbe essere avviata una volta che la rianimazione è quasi completa e il tratto gastrointestinale è vitale.” (Coccolini, 2018b)
Come sostenuto anche da Padar (2019), “i pazienti ricevono circa il 50% del loro obiettivo energetico quando viene somministrata solo la NE. La somministrazione sia della nutrizione enterale che parenterale consente ai pazienti di ricevere quasi il 70% del loro obiettivo energetico. La somministrazione tardiva piuttosto che precoce di NP supplementare aiuta nel recupero della debolezza muscolare nei pazienti critici.” (Yandell, 2019)
Al contrario, Coccolini (2018b) afferma che “la nutrizione parenterale (NP) dovrebbe essere iniziata il prima possibile.”
Fitzpatrick (2017), in riferimento alla presa in carico del paziente con addome aperto nell’ambito della nutrizione, sottolinea l’importanza di:
- “monitorare le entrate e le uscite;
- somministrare liquidi e sangue secondo prescrizione medica;
- prelevare i campioni per i test di laboratorio come da prescrizione e visionare i risultati;
- monitorare le indicazioni e gli endpoint di un’adeguata sostituzione del volume come variazione della gittata sistolica, variazione della pressione del polso, PVC e SpO2 venosa centrale;
- somministrare e monitorare la NE;
- monitorare il peso del paziente e i parametri nutrizionali, come i livelli di prealbumina, albumina, PCR e settimanalmente le urine delle 24 ore per rilevare il livello di azoto urico e di conseguenza regolare il piano nutrizionale.” (Fitzpatrick, 2017)
4. Bilancio idro-elettrolitico: “la sostituzione di liquidi dovrebbe basarsi sul raggiungimento di una pressione arteriosa media ≥65 mmHg, PVC 8-12 mmHg in combinazione con ScvO2 >70% e una diuresi >0.5 ml/kg/h durante le prime 6 ore di sostituzione; questi obiettivi possono essere raggiunti trasfondendo emoderivati nella prima fase di sostituzione, riducendo al minimo le infusioni di cristalloidi e considerando l’uso di soluzione salina ipertonica, che può provocare un minore edema tissutale.
Prevenzione dello squilibrio idro-elettrolitico:
- monitorare i livelli di elettroliti e di emoglobina almeno giornalmente, più frequentemente nei pazienti più gravi” come sostenuto anche da Gurusamy (2016);
- “integrare gli elettroliti secondo necessità in base ai risultati;
- valutare e quantificare le perdite di liquidi;
- scegliere i liquidi per la rianimazione e la sostituzione delle perdite in base al sodio sierico e allo stato del volume sistemico;
- pesare il paziente giornalmente per identificare la potenziale perdita di liquidi o l’eccessiva rianimazione;
- utilizzare NPWT.” (Fitzpatrick, 2017)
Padar (2019) riporta che “importanti volumi di liquidi somministrati durante la fase rianimatoria sono un noto fattore di rischio di ACS. Dopo l’iniziale rianimazione con liquidi e l’attenuazione della fase acuta, si dovrebbe tentare la rimozione del liquido in eccesso il prima possibile, utilizzando diuretici o terapia sostitutiva renale, se necessario, poiché questi approcci hanno dimostrato di ridurre la IAP.”
5. Gestione delle complicanze
1. Emorragia: la prevenzione emorragica prevede l’utilizzo della “NPWT lontano dai vasi nel paziente con sanguinamento attivo e mediante l’impostazione della pressione negativa iniziale bassa, compresa tra -25 e -50 mmHg in quanto l’applicazione di elevate pressioni negative (-125 mmHg) alla ferita tramite il sistema NPWT può aggravare l’emorragia nel paziente con emostasi inadeguata. Sono disponibili dispositivi commerciali per disperdere la pressione negativa sull’intera medicazione o spugne per ridurre al minimo il rischio di sanguinamento e massimizzare la rimozione del fluido.” (Fitzpatrick, 2017)
Al riscontro di un’emorragia in atto occorre “interrompere la fonte di aspirazione collegata alla NPWT, valutare il paziente per compromissione emodinamica associata all’emorragia e contattare il medico; successivamente considerare un’impostazione di aspirazione più bassa fino a quando la causa dell’emorragia non viene corretta.” (Fitzpatrick, 2017)
2. Sindrome compartimentale addominale: nel paziente a rischio o con ACS:
- “la produzione di urina dovrebbero essere compresi tra 0.5 e 1 ml/kg/h;
- Il monitoraggio della diuresi dovrebbe essere svolto ogni 30 minuti per valutare la risposta ai liquidi;
- La valutazione dei livelli di sedazione ed eventuale necessità del blocco neuromuscolare va effettuata frequentemente.
I trattamenti per ridurre l’IAH prima della decompressione chirurgica includono:
- economia nella somministrazione dei liquidi, assicurando la perfusione sistemica e regionale;
- evacuazione dei contenuti intraluminali e delle lesioni occupanti spazio intra-addominali;
- miglioramento della compliance della parete addominale;
- decompressione percutanea;
- drenaggio sterile dei liquidi biologici.” (Munn, 2021)
3. Sepsi: è necessario un “trattamento aggressivo dell’infezione nel paziente con OA.” (Fitzpatrick, 2017)
La causa principale di infezione nel paziente con OA è “l’ambiente non adeguatamente disinfettato e l’esecuzione del cambio medicazione al letto del paziente.” (Chipu, 2017)
Fitzpatrick (2017) esplica i punti salienti in materia di prevenzione, riconoscimento e gestione della sepsi. “Prevenzione e riconoscimento:
- intervenire precocemente per condizioni emodinamiche avverse e segni di infiammazione e infezione come febbre, tachicardia, ipotensione e leucociti elevati;
- valutare la ferita per monitorare segni di infezione come liquido di drenaggio purulento e infiammazione;
- monitorare i seguenti parametri: variazione della gittata sistolica (SVV), variazione della pressione di polso (PPV), PVC, saturazione di ossigeno venoso centrale (ScvO2), gittata cardiaca, diuresi;
- raggiungere una chiusura fasciale primaria definitiva e precoce.
Gestione:
- somministrare terapia antibiotica ad ampio spettro;
- somministrare antibiotici mirati secondo le colture di campioni intraoperatori e altre colture;
- implementare il controllo chirurgico o interventistico della fonte per eradicare l’origine della sepsi addominale dovuta ad ascesso;
- avvalersi della TAC addome;
- applicare una gestione aggressiva delle infezioni utilizzando altre strategie come NPWT;
- implementare gli interventi di gestione della disfunzione organo-specifica;
- stabilire una chiusura precoce della fascia primaria definitiva.” (Fitzpatrick, 2017)
Nguyen (2021) riporta che “i dispositivi di protezione del bordo della ferita sono progettati per proteggere i bordi della ferita addominale dalla contaminazione e dai traumi durante la laparotomia. Tra questi, il design a doppio anello ha mostrato una significativa riduzione delle infezioni del sito chirurgico dopo l’intervento chirurgico addominale.”
4. Fistola entero-atmosferica: “nella fistola ad alto rendimento, il mantenimento dell’integrità cutanea è della massima importanza, per prevenire l’erosione dolorosa e progressiva dei tessuti circostanti.
La cura della ferita locale può essere tentata con NPWT applicato sul tessuto di granulazione intorno alla fistola, per controllare le uscite della fistola.” (Chiara, 2016)
“Liquidi ed elettroliti vengono persi in grandi quantità tramite l’EAF. Si raccomanda la somministrazione di cloruro di sodio per correggere il volume ridotto di liquido extracellulare e la somministrazione di potassio per equilibrare le perdite urinarie.
Il controllo e la raccolta delle perdite dell’EAF sono componenti necessari della gestione di questa complicanza. I principi generali di gestione includono garantire che i liquidi siano drenati efficacemente per prevenire il contatto del materiale intestinale con la cute. La protezione della pelle, il controllo delle uscite e la gestione del dolore sono elementi necessari del piano di cura per i pazienti con EAF.” (Fitzpatrick, 2017)
La stessa Fitzpatrick (2017) riporta gli interventi preventivi utili per evitare l’insorgenza di EAF come complicanza, oltre al raggiungimento della chiusura fasciale precoce:
- “utilizzare medicazioni non aderenti per proteggere gli organi, evitare il contatto viscerale con medicazioni di garza o medicazioni aderenti a pressione negativa;
- ridurre al minimo l’uscita della fistola inserendo un sondino nasogastrico;
- implementare la soppressione dell’acido con inibitori di pompa protonica o antagonisti dei recettori dell’istamina per diminuire la quantità e l’acidità delle secrezioni gastrointestinali, l’uso di octreotide, somministrato per via sottocutanea, inibisce la secrezione esocrina gastrointestinale e pancreatica.”
Per riconoscere lo sviluppo di un’EAF si deve osservare il “drenaggio del liquido intestinale da un foro o fori nell’intestino, che è esposto nell’addome aperto” Fitzpatrick (2017).
Vengono inoltre riportati gli interventi da attuare per la gestione della EAF riportando:
- “iniziare precocemente la NE;
- controllare il drenaggio;
- valutare la chiusura della fistola controllando il drenaggio;
- monitorare e registrare la quantità e le caratteristiche dell’uscita della fistola. Una fistola drenante provoca marcate perdite di sodio, potassio, cloruro e bicarbonato;
- monitorare e correggere i disturbi elettrolitici;
- sigillare piccole aree di perdita di fistola al primo riconoscimento;
- applicare dispositivi per stomia e altre strategie per il controllo del drenaggio locale dell’EAF.” (Fitzpatrick, 2017)
“I sacchetti di stomia per la gestione delle ferite permettono alle fuoriuscite della fistola di essere deviate lontano dalla cute perilesionale, consentendo anche la raccolta e il conteggio delle perdite di materiale intestinale.
I margini irregolari della cute e le grosse perdite di materiale causano la perdita di adesione del sacchetto di stomia alla cute, risultante nella perdita di materiale che risulta angosciante e dolorosa per il paziente. L’applicazione del sacchetto di stomia necessita di due infermieri: uno necessario per la preparazione della cute e l’applicazione del sacchetto mentre l’altro controlla le perdite della fistola mediante l’uso dell’aspiratore, per evitare di sporcare i prodotti barriera prima dell’applicazione del sacchetto.
Selezionando il sacchetto, dovrebbe essere sufficientemente largo da lasciare come minimo un pollice di contatto adesivo con la cute quando si taglia la grandezza della ferita e si fa fronte (idealmente) da tre a quattro ore di drenaggio.
Modeste secrezioni intestinali contengono enzimi digestivi attivi, come tripsina, lipasi e peptidasi, che erodono la cute. La presenza di bile nell’output della fistola irrita la pelle attraverso l’azione corrosiva dei sali biliari e fosfolipidi. Anche i range di pH alcalino che partono da 7.5 in presenza di fluidi colici fino a 8.3 con succo pancreatico compromettono l’integrità cutanea. L’esposizione epidermica ai fluidi, enzimi digestivi e pH estremi possono causare macerazione, disepitelizzazione, eritema ed erosione.
Il primo passo nella protezione della cute è pulirla con acqua calda. Non dovrebbero essere usati saponi e lozioni a causa del rischio di irritazione cutanea e qualche residuo potrebbe impedire l’adesione del sacchetto di stomia.
Dopo la pulizia, può essere applicato un sottile strato di liquido o spray barriera non erosivo per fornire una pellicola protettiva sull’epidermide. Non dovrebbero essere utilizzati prodotti contenenti alcool perché causano dolore e disagio durante l’applicazione.
Le paste di barriera cutanea sono tipologie semisolide e hanno diversi utilizzi. Possono essere utilizzate per riempire le pieghe, coprire i punti dove si incontrano i margini sezionati delle barriere solide e coprire la cute che rimane esposta dopo l’applicazione di una barriera solida.” (Curtis, 2014)
5. Frozen abdomen, perdita di dominio e ernia incisionale addominale: queste complicanze si possono tentare di prevenire attraverso “l’utilizzo della NPWT e il raggiungimento della chiusura fasciale precoce entro 5-7 giorni.” (Fitzpatrick, 2017) Il riconoscimento di tali complicanze si basa sull’osservazione di “aspetto fasciale congelato con incapacità di unire i bordi della ferita con NPWT o Wittmann patch, ecc.; contenuti addominali sporgenti e disagio del paziente.” (Fitzpatrick, 2017)
6. Sindrome da distress respiratorio acuto: i fattori di rischio per lo sviluppo di tale complicanza sono “trasfusioni di sangue multiple e lesioni traumatiche.” (Fitzpatrick, 2017)
Questa sindrome può essere prevenuta attraverso i seguenti interventi:
- “valutazione dello stato respiratorio per segni di sofferenza come tachipnea e aumento del lavoro respiratorio;
- ottenimento di campioni e monitoraggio dei valori di emoglobina;
- valutazione di variazioni alla radiografia del torace indicative di edema polmonare non cardiogeno;
- utilizzo della pulsossimetria continua.” (Fitzpatrick, 2017)
Il riconoscimento dell’ARDS si basa sulla presenza di “ipossiemia refrattaria come evidente all’analisi dell’emogasanalisi o dalla diminuzione di SpO2”. (Fitzpatrick, 2017)
La gestione di tale complicanza prevede l’utilizzo di “strategie ventilatorie per migliorare l’ossigenazione e strategie di reclutamento alveolare, incluso il posizionamento.” (Fitzpatrick, 2017)
7. Catabolismo: Fitzpatrick (2017) riporta gli interventi di prevenzione e gestione del paziente con OA in stato catabolico. “Prevenzione:
- identificare i pazienti a maggior rischio a causa di deficit nutrizionali preesistenti;
- iniziare la NE subito dopo la chirurgia per il controllo del danno e l’OA;
- posizionare un sondino (nasogastrico, postpilorico, nasodigiunale) durante il periodo intraoperatorio precoce e garantire che le esigenze nutrizionali vengano stabilite e fornite;
- garantire un punto di partenza nel supporto nutrizionale di 1.5-2.5 g/kg al giorno di proteine per ottenere un bilancio azotato positivo e monitorare le misurazioni in corso dei parametri nutrizionali.
Il riconoscimento di tale complicanza è basato sulla presenza di peso anomalo e livelli anormali di proteine della fase acuta.
Gestione:
- monitorare i parametri nutrizionali come i livelli di prealbumina, albumina e proteina C-reattiva e il livello settimanale di azoto ureico nelle 24 ore per determinare il fabbisogno calorico, valutare l’equilibrio proteico e regolare di conseguenza il piano nutrizionale;
monitorare e sostituire sodio, potassio, cloruro e bicarbonato per raggiungere livelli normali e ripristinare uno stato metabolico stabile;
valutare gli indicatori di efficacia del supporto nutrizionale come la granulazione della ferita;
pesare il paziente ogni giorno e affrontare le perdite con il team.”
8. Perdita della funzionalità intestinale: Fitzpatrick (2017) riporta gli interventi per prevenire la perdita della funzionalità intestinale: “NE precoce e mobilità precoce e progressiva.” Il riconoscimento di tale complicanza si riscontra con “diminuzione o perdita dei rumori intestinali e alvo chiuso a feci e gas.”
9. Insufficienza renale acuta (IRA): la prevenzione di tale complicanza si basa sui seguenti interventi:
- “stretto bilancio idro-elettrolitico;
- valutazione dei segni di sostituzione ottimale e completa sostituzione del volume (SVV, PPV, PVC, ScvO2, diuresi);
- monitoraggio dei livelli di creatinina e azoto ureico;
- raggiungimento della chiusura fasciale primaria definitiva e precoce.” (Fitzpatrick, 2017)
Il riconoscimento di tale complicanza deriva dall’osservazione di: “oligo/anuria e aumento dei livelli di creatininemia e azoto ureico.” (Fitzpatrick, 2017)
La gestione dell’IRA è basata sulla “sostituzione di liquidi fino al raggiungimento e mantenimento di valori normali dei parametri quali SSV, PPV, PVC, ScvO2 e diuresi evitando la sostituzione eccessiva e confezionamento precoce della chiusura primaria definitiva.” (Fitzpatrick, 2017)
6. Tipologie e gestione delle medicazioni: L’articolo elaborato da Le “Wound drainage site” (2021) sviluppa le seguenti best practice recommendations per una gestione ottimale della medicazione e dei drenaggi nel paziente sottoposto a OA:
- “monitorare il sito di drenaggio della ferita per segni di infezione;
- eseguire le pratiche che riducono il rischio di contaminazione attraverso o intorno alla superficie esterna del drenaggio;
- eseguire controlli frequenti e svuotare il materiale drenato quando necessario;
- eseguire medicazioni di routine e valutare la pervietà del drenaggio e l’integrità della cute;
- utilizzare la tecnica asettica durante le procedure che comportano l’alterazione o la rimozione del tubo di drenaggio.”
Padar conferma lo studio di Seternes (2016), il quale sostiene che “la sostituzione della VAC su pazienti con OA può essere eseguita in sicurezza al di fuori della sala operatoria.”
Padar, nell’articolo “Abdominal Compartment Syndrome: Improving Outcomes With A Multidisciplinary Approach – A Narrative Review” (2019), ribadisce che attualmente la preferenza per la medicazione dell’OA, sia in pazienti traumatizzati che non traumatizzati, risulta essere NPWT associata a tecniche di trazione fasciale continua in quanto “questa tecnica garantisce un’adeguata evacuazione dell’ascite ricca di markers pro-infiammatori e contaminazione, migliora l’assistenza infermieristica e previene la retrazione dei bordi fasciali, facilitando la chiusura fasciale definitiva precoce. La terapia dell’OA richiede un’assistenza infermieristica estesa. La raccolta completa dei liquidi peritoneali è spesso difficile da ottenere e può portare a gravi compromissioni della cute anche nonostante frequenti cambi di medicazione. L’applicazione della NPWT ha ridotto significativamente il tasso di complicanze e il carico di lavoro infermieristico. La pressione negativa ottimale è stata suggerita essere -125 mmHg, con un livello più basso (-70 mmHg) quando si sospetta un sanguinamento attivo dovuto a coagulopatia.”
Come affermato anche da Coccolini, “l’instillazione dell’addome con liquidi può essere considerata in associazione a NPWT in quanto ciò può migliorare l’umidità delle anse intestinali, prevenire le aderenze e migliorare i tassi di chiusura addominale.” (Padar, 2019)
Chiara (2016) arriva alla conclusione che “i dispositivi commerciali sono associati a una migliore assistenza infermieristica in quanto la pressione negativa è controllata dal computer il quale avverte eventuali perdite del sistema”, permettendo in questo modo di intervenire precocemente.
Fitzpatrick (2017) riporta i principali interventi infermieristici da eseguire per una gestione ottimale della medicazione nel paziente sottoposto a OA:
- “monitoraggio continuo della ferita per individuare segni di guarigione o complicanze;
- valutazione del sistema NPWT da parte dell’infermiere per quanto riguarda la sua integrità, il drenaggio degli output, l’apporto vascolare alla ferita e qualsiasi area di nuova perdita di liquido intestinale.”
7. Mobilizzazione e prevenzione delle lesioni da pressione: “deve essere osservata estrema attenzione quando si mobilizza il paziente con lo scopo di prevenire le ulcere da pressione, in quanto gli organi addominali non sono protetti dalla parete addominale. Rimane una questione controversa l’utilizzo della posizione prona nella gestione del paziente critico, a causa della pressione esercitata sugli organi addominali durante tale posizione”, i quali sono privi del supporto della parete addominale. (Gurusamy, 2016)
“È stato dimostrato che la mobilizzazione precoce, la pratica di applicare la terapia fisica entro i primi 2-5 giorni di quadro critico, migliora lo stato di mobilità, la forza muscolare e aumenta i giorni di vita e velocizza la dimissione. I sistemi NPWT possono consentire movimenti attivi e una maggiore libertà di mobilizzazione “precoce” grazie al supporto che essi forniscono alla parete addominale.” (Padar, 2019)
Coccolini (2018b) aggiunge che “il riposo a letto prolungato è associato a un aumento significativo della morbilità.”
8. Prevenzione dell’ipotermia: come confermato da Fitzpatrick (2017), Bernardin (2012) sostiene che “la gestione post-operatoria del paziente con OA deve prevedere il riscaldamento aggressivo del paziente mediante infusione di liquidi caldi, coperte termiche, lavaggio con liquidi caldi di stomaco e vescica. L’ambiente deve essere caratterizzato da un basso tasso di umidità per ridurre le perdite di calore.” (Bernardin, 2012)
Inoltre Fitzpatrick (2017) aggiunge i seguenti interventi infermieristici da attuare:
- “monitorare continuamente o frequentemente la temperatura interna;
- esaminare i valori di laboratorio, in particolare i valori per l’acidosi, un fenomeno comune dopo il controllo del danno dovuto alla diminuzione di perfusione tissutale e ipossia.
I livelli di gas nel sangue e di lattati saranno indicatori di acidosi metabolica derivante da perdite di sangue e liquidi con ipoperfusione e conseguente debito di ossigeno ai tessuti.”
9. Gestione del dolore e della sedazione: lo studio svolto da Bernardin (2012) riguardo al blocco neuromuscolare mediante la somministrazione di curari afferma che “è noto che la somministrazione di questi farmaci per più di 24-48 ore si associa al rischio di polmonite, danno nervoso periferico, neuromiopatia e complicanze tromboemboliche.”
Al contrario, Fitzpatrick (2017) sostiene che “l’utilizzo di agenti del blocco neuromuscolare possono prevenire la retrazione del margine fasciale e fornire una migliore compliance della parete addominale, una situazione che può facilitare l’eventuale chiusura fasciale primaria. Tuttavia, le evidenze riguardo l’utilizzo di agenti per il blocco neuromuscolare paragonato alla sedazione semplice è ambiguo, e perciò i curari attualmente non sono universalmente implementati.”
“L’indicazione principale per la sedazione/paralisi nel paziente con OA è il rischio di ACS ricorrente. Se l’ACS è gestita efficacemente con misure terapeutiche, dovrebbe essere intrapreso un graduale risveglio del paziente.” (Padar, 2019)
Secondo l’articolo “Open Abdomen in Trauma and Critical Care” pubblicato da Fitzpatrick (2017), gli interventi infermieristici indicati per il controllo del dolore nel paziente con addome aperto sono:
- “somministrazione di farmaci sedativi e analgesici in infusione continua o in boli a intermittenza per aumentare il comfort del paziente;
- valutazione quotidiana dell’uso continuo dei sedativi, essa può essere utile nel ridurre l’ipersedazione e i suoi effetti;
- comunicazione con il paziente riguardo il dolore e l’ansia e i loro effetti e il piano per la loro gestione.”
10. Cura di sé: “nel paziente con OA, gli organi addominali non sono protetti dalla parete addominale, per questo deve essere osservata estrema attenzione quando si mobilizza il paziente con lo scopo di eseguire l’igiene personale e/o prevenire le ulcere da pressione”. (Gurusamy, 2016)
11. Supporto psicologico: “dopo la stabilizzazione dalla patologia acuta iniziale e i molteplici interventi, il paziente inizia a sperimentare alcune delle innumerevoli complicanze e avversità che accompagnano la condizione sottostante e i successivi trattamenti. I membri del team di terapia intensiva, specialmente gli infermieri, si trovano nella posizione in cui devono fornire un supporto emozionale e una serie di istruzioni atte a promuovere lo stato di salute. Il paziente e i suoi famigliari hanno bisogno di ricevere educazione riguardo molti dei trattamenti, a cui il paziente è sottoposto, riguardo a come possono essere coinvolti nella pianificazione delle dimissioni e all’uso delle risorse.” (Fitzpatrick, 2017)
Un altro aspetto da considerare, che Chipu nell’articolo “Experiences of registered nurses caring for patients with an open abdomen in an intensive care unit in Gauteng” (2017) affronta, è quello relativo all’équipe: “il personale infermieristico subisce spesso problemi psicologici a causa delle frustrazioni a cui è soggetto quando assiste pazienti con OA. Gli infermieri possono diventare molto stressati e alcuni addirittura rifiutano apertamente di assistere i pazienti con OA e preferiscono essere trasferiti in altre unità operative. L’infermieristica è un’occupazione stressante perché gli infermieri lavorano con persone che soffrono e che hanno bisogno di molta attenzione, compassione e simpatia.”
DISCUSSIONE
Sintesi delle evidenze
Il paziente con open abdomen presenta un addome disteso, il quale si traduce in un aumento della pressione intra-addominale e intra-toracica, compromettendo in questo modo, un’efficace espansione polmonare. Seppur non esistano protocolli di gestione ventilatoria, è necessario monitorare la IAP ed evitare di somministrare PEEP a pressioni elevate.
“La misurazione della IAP è essenziale nei pazienti critici a rischio di IAH/ACS (Grado 1B) e dovrebbe essere misurata ogni 12 ore e ogni 4-6 ore una volta che è stata rilevata IAH/ACS o se si verifica un’insufficienza d’organo.” (Coccolini, 2018b)
Un riconoscimento precoce di questa situazione clinica permette di intervenire tempestivamente per evitare di andare incontro a complicanze e MODS. È di fondamentale importanza un supporto nutrizionale adeguato alle esigenze metaboliche del paziente e un tempestivo controllo della fonte settica.
“L’alimentazione orale non è controindicata e dovrebbe essere utilizzata ove possibile. (Grado 2C)” (Coccolini, 2018b)
La gestione rianimatoria deve evitare l’eccessiva somministrazione di liquidi per ridurre il problema dell’edema intestinale. È utile pesare il paziente quotidianamente per identificare la potenziale perdita di liquidi o l’eccessiva rianimazione. L’infermiere deve essere a conoscenza delle potenziali complicanze intrinseche della tecnica open abdomen, cercare di prevenirle ed essere in grado di riconoscerle precocemente. Non è possibile formulare raccomandazioni sulla mobilizzazione precoce di pazienti con OA in merito alla cura di sé e alla prevenzione delle ulcere da pressione. Il paziente con OA è soggetto ad ipotermia, causata prevalentemente dalla perdita di liquidi a livello addominale e la quale comporta uno squilibrio sulla cascata coagulativa. È di fondamentale importanza il ripristino della normotermia attraverso infusione di liquidi caldi e coperte termiche. La sedazione permette un maggiore comfort del paziente. Riducendo il dolore, si riduce anche l’instaurarsi di determinate complicanze. Può essere utilizzato il blocco neuromuscolare per prevenire la retrazione del margine fasciale e quindi poter eseguire una chiusura fasciale primaria. Il supporto psicologico è un aspetto importante dell’assistenza infermieristica durante tutta la presa in carico di questa tipologia di paziente in quanto la situazione nel quale egli si trova è estremamente delicata e spesso fonte di importante disagio e stress. È necessario fornire al paziente e ai famigliari gli strumenti necessari per focalizzarsi sulla sopravvivenza e sui piccoli miglioramenti che nel lungo periodo permetteranno di raggiungere la dimissione ospedaliera. È necessario un approccio collaborativo multidisciplinare per gestire al meglio il paziente e le complicanze, che si possono sviluppare in una situazione clinica così critica e potenzialmente in rapida evoluzione.
Limiti
La difficoltà di gestione del paziente sottoposto ad open abdomen è dovuta al fatto che attualmente non esistono linee guida, protocolli, procedure infermieristici basati sulle ultime evidenze scientifiche. In linea generale, una standardizzazione risulta difficoltosa in quanto sono presenti molteplici fattori potenzialmente in grado di influenzare l’esito dei pazienti che risultano difficoltosi da analizzare. Limiti di questa ricerca sono relativi alla mancanza di studi e di conseguenza di standardizzazione delle strategie di gestione infermieristica dei pazienti con addome aperto.
CONCLUSIONI
Questa revisione narrativa ha permesso di individuare una panoramica degli interventi assistenziali evidence-based per l’OA, sebbene la letteratura scientifica infermieristica in merito, sia ancora scarsa.
La ridotta numerosità dei campioni, l’eterogeneità della popolazione trattata, le difficoltà di randomizzazione, l’impossibilità del doppio cieco e la difficoltà di standardizzare la procedura chirurgica, sono alcuni dei punti che ostacolano la realizzazione di linee guida o procedure.
Il proposito per il futuro è quello di stimolare gli infermieri delle terapie intensive a condividere le loro esperienze sulla cura di questa tipologia di pazienti ed aiutare, in tal modo, la comunità infermieristica a fare luce su alcuni temi quali: la nutrizione, la mobilizzazione, la cura di sè ed il supporto psicologico del paziente e dei membri dell’équipe.
BIBLIOGRAFIA
- Carlson, G.L., Patrick, H., Amin, A.I., McPherson, G., MacLennan, G., Afolabi, E., Mowatt, G., Campbell, B., (2013 Jun). Management of the open abdomen: a national study of clinical outcome and safety of negative pressure wound therapy. Annals of Surgery. 257(6):1154-9.
- Cecere, F., Kafka, R., Maglione, M., Öfner, D., Wykypiel, H., (2017 Sep). “The abdominal catastrophe” Open abdomen with multiple small intestinal fistulas: a children’s pacifier makes the difference. European Surgery 49:293-297.
- Chiara, O., et al. (2016 Jan). International consensus conference on open abdomen in trauma. Journal of Trauma and Acute Care Surgery. 80(1):173-83.
- Chipu, M.G., Kearns, I., Nel, W.E., (2017). Experiences of registered nurses caring for patients with an open abdomen in an intensive care unit in Gauteng. Health SA Gesondheid. 22:166-173.
- Coccolini, F., Ivatury, R., Sugrue, M., Ansaloni, L., (2018). Open Abdomen – A Comprehensive practical manual – Hot Topics in Acute Care Surgery and Trauma. In: Tarasconi, A., Chiara O., Cimbanassi, S., Birindelli, A., Cirocchi, R., Tugnoli, G., Di Saverio, S., eds. Open abdomen complications: prevention and management. Springer, 221-222. (a)
- Coccolini, F., et al. (2018 Feb). The open abdomen in trauma and non-trauma patients: WSES guidelines. World Journal of Emergency Surgery. 13:7. (b)
- Cristaudo, A.T., Jennings, S.B., Gunnarsson, R., DeCosta, A., (2017 Feb). Complications and Mortality Associated with Temporary Abdominal Closure Techniques: A Systematic Review and Meta-Analysis. The American Surgeon. 83(2):191-216. (a)
- Cristaudo, A.T., Jennings, S.B., Hitos, K, Gunnarsson, R, DeCosta, A., (2017 Feb). Treatments and other prognostic factors in the management of the open abdomen: A systematic review. Journal of Trauma and Acute Care Surgery. 82(2):407-418. (b)
- Curtis, K., Judson, K., (2014 Feb). Management of fistulae in patients with open abdomen. Nursing standard. 28, 25: 56-64.
- Di Saverio, S., Tarasconi, A., Walczak, D.A., Cirocchi, R., Mandrioli, M., Birindelli, A., Tugnoli, G., (2016 Feb). Classification, prevention and management of entero-atmospheric fistula: a state-of-the-art review. Langenbeck’s Archives of Surgery. 401(1):1-13.
- Fitzpatrick, E.R., (2017 Oct). Open Abdomen in Trauma and Critical Care. Critical Care Nurse. 37(5):22-45.
- Gurusamy, K., Davidson, B., (2016 Jan). Management and treatment options for patients with open abdomen. Nursing Standard. 30.
Le, L., (2021). WOUND DRAINAGE SITE. Cited in: JBI EBP Database at http://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=jbi&NEWS=N&AN=JBI176. - Munn, Z.J.A., (2021). BURNS PATIENTS: ABDOMINAL COMPARTMENT SYNDROME. Cited in: JBI EBP Database at http://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=jbi&NEWS=N&AN=JBI7971.
- Nguyen, D.H., (2021). SURGICAL SITE INFECTIONS (OPEN ABDOMINAL SURGERY): WOUND EDGE PROTECTION DEVICES. Cited in: JBI EBP Database at http://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=jbi&NEWS=N&AN=JBI12555.
- Padar, M., Reintam Blaser, A., Talving, P., Lipping, E., Starkopf, J., (2019 Dec). Abdominal Compartment Syndrome: Improving Outcomes With A Multidisciplinary Approach – A Narrative Review. Journal of Multidisciplinary Healthcare. 12:1061-1074.
- Seternes, A., Fasting, S., Klepstad, P., Mo, S., Dahl, T., Björck, M., Wibe, A., (2016 May). Bedside dressing changes for open abdomen in the intensive care unit is safe and time and staff efficient. Critical Care. 20(1):164.
- Slade, D.A.J., Carlson, G.L., (2013). Takedown of enterocutaneous fistula and complex abdominal wall reconstruction. Surgical Clinics of North America. 93: 1163-1183.
- Yandell, R., Wang, S., Bautz, P., Shanks, A., O’Connor, S., Deane, A., Lange, K., Chapman, M., (2019 May). A retrospective evaluation of nutrition support in relation to clinical outcomes in critically ill patients with an open abdomen. Australian Critical Care. 32(3):237-242.
Martina Finistrella
Tutor e Docente del Corso di Laurea in Infermieristica del Fatebenefratelli di Milano, Università degli Studi di Milano, Facoltà di Medicina e Chirurgia, Polo Universitario ASST Fatebenefratelli Sacco. Corso di Porta Nuova 23 – 20121, Milano.
Master of Science in Nursing (MSN), Educator and Professor at the Degree in Nursing – Fatebenefratelli Hospital of Milan, University of Milan, Faculty of Medicine and Surgery, ASST Fatebenefratelli Sacco University Center, Milan.
martina.finistrella@asst-fbf-sacco.it
Camilla Moretti